2014抗血小板药物治疗反应多样性临床检测和处理的中国专家建议
抗血小板药物治疗反应多样性是近年心血管领域的热点问题。在急性冠状动脉综合征和经皮冠状动脉介入治疗(pereutaneous coronary intervention,PCI)的病理生理过程中,血小板的黏附、活化和聚集起着重要作用。阿司匹林和P2 Y12受体抑制剂(如氯吡格霄)作为两类最常用的抗血小板药物,是目前ACS和(或)PCI术后预防血栓事件的基石,被广泛地应用于冠心病的一级预防和二级预防。本世纪初以来,随着氯吡格雷的广泛应用,这一领域的研究呈井喷式增长。但迄今为止,在其检测和处理方面仍缺乏一致的见解。对此,韩雅玲、 高润霖、霍勇等专家撰写了抗血小板药物治疗反应多样性临床检测和处理的中国专家建议,文章2014 年 12 月发表在《中华心血管病杂志》上。
一、抗血小板治疗反应多样性
实验研究表明,不同个体对阿司匹林和氯吡格雷治疗的反应性差异很大,低反应或无反应者经治疗后测得的相关实验室血小板功能与未经治疗者相近,故最早将其称为阿司匹林或氯吡格雷“抵抗”。由于血小板功能受全身多方面因素影响而非仅限于特定药物对血小板的直接作用,“抵抗”一词事实上是指药物不能作用于特定的靶点,所以用“抵抗”描述此现象并不确切。
近年来,多以个体对抗血小板治疗反应降低或抗血小板治疗后咀小板高反应性(high on-tredtment platelet reaCtivity,HPR)取代“抵抗”一词,但在许多文献中“抵抗”仍作为习语沿用。
现阶段,由于检测方法多样,对于上述抗血小板药物抵抗或疗效多样性缺乏统一评价标准,通常是指同一种抗血小板药物在不同患者中所产生的不同抗血小板效应。其中经治疗后血小板反应性仍较高者(即血小板功能检测提示mL小板活性抑制不足),血栓事件发生风险可能较高;反之(血小板活性抑制过多)则可能引发高出血风险。
随着血小板功能检测方法学的改进,临床中逐渐认识到患者接受抗血小板药物治疗时对药物的反应性有很大不同,呈连续、正态(或接近正态)分布,由此提出抗血小板药物治疗反应多样性的概念。
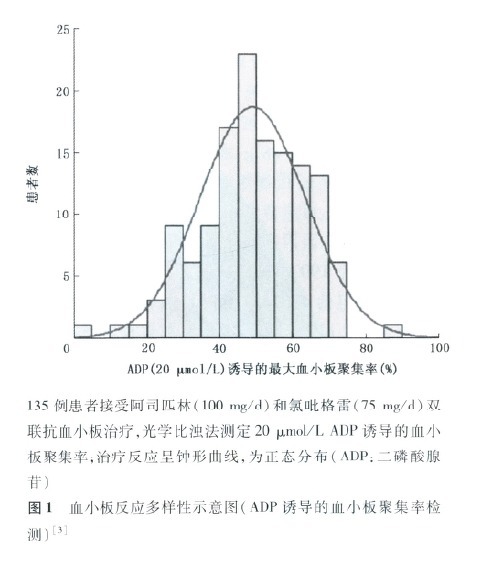
二、抗血小板治疗反应多样性的发生机制和影响因素
抗血小板治疗反应多样性受多种因素影响,归纳起来主要有三方面:遗传因素、细胞因素和临床因素。
1、遗传因素:研究发现,阿司匹林或氯吡格雷的药代动力学和药效学通路上,细胞色素 P450(cytochrome P450,CYP)2C9、CYP3 A4、CYP3 A5、CYP2C19、ABCB1、PON1、COX-1和P2Y12受体等基因变异与血小板对阿司匹林或氯吡格雷的反应性有关。氯吡格雷是一种前体药,经肠道吸收后约85%~90%直接被酯化为无活性产物,仅10%~15%通过肝细胞CYP代谢成为活性药物。因此,CYP系统,特别是CYP2C19对氯吡格雷活化的作用至关重要。
根据CYP2C19的不同基因型表现,可分为4种代谢表型:(1)超快代谢型:携带CYP2C19等位基因*17的纯合子或杂合子,即CYP2C19*17/*17或CYP2C19*17/*1(在中国人群中频率极低)。(2)快速代谢型(正常代谢型):携带GYP2C19等位基因*1的纯合子,野生型,即CYP2C19*1*1。(3)中间代谢型:携带1个CYP2C19功能缺失(loss-of-function,LOF)等位基因和1个野生型基因的杂合子,可表现为CYP2C19*1*2,或*1/*3。(4)慢代谢型:携带2个LOF等位基因,可表现为突变纯合子如CYP2C19*2/*2或*3/*3(后者较少见),也可能表现为突变杂合子,如CYP2C19*2/*3。
大型临床研究结果表明,携带CYP2C19 LOF等位基因(主要是CYP2C19*2)的患者临床预后较差,主要原因是此类患者体内氯吡格雷活化代谢率下降,不能充分抑制血小板聚集,导致缺血事件率上升。Simon等对高加索人群的研究证明,携带任意2个LOF等位基因的患者(CYP2C19 *2、*3、*4或*5)在PCI术后1年随访期中,比不携带者有更高的缺血事件率,提示CYP2C19的遗传变异性对PCI术后的长期临床预后影响较大。
药物代谢酶的基因多态性是影响因素之一,但并非影响抗血小板药物药代和药效的唯一因素。氯吡格雷抵抗的发生机制与阿司匹林有相似之处,只是涉及到不同的酶和不同的药物-药物相互作用。据报道,肠道、肝脏、血小板三大部位有20多种酶的基因多态性都与氯吡格雷抵抗有关,其中肝细胞色素P450(CYP)2C19酶系的多态性与氯吡格雷反应多样性的关系最密切。普拉格雷也有报道受遗传多态性影响,这与氯吡格雷机制相似,虽然涉及的酶不同。在氯吡格雷抗血小板反应的变异中,CYP2C19基因多态性大约占12%的归因效度,仅能部分解释氯吡格雷抗血小板治疗反应多样性。
2、细胞因素:细胞因素也可能影响阿司匹林或氯吡格雷的抗血小板疗效,例如血小板更新的加速可能降低抗血小板药物的治疗反应。经肝脏代谢生成抗血小板活性代谢产物这一过程,通常也受CYP同工酶系基线水平和其他细胞内因素影响。另外,P2Y12和P2Yl受体的上调,以及不依赖于P2Y12受体的血小板信号转导通路,可能对氯吡格雷治疗反应多样性有一定程度影响。这一作用在一些特殊疾病情况下较明显,如糖尿病患者体内往往有一种或多种细胞膜受体或受体后的调节功能异常,对膜表面抗血小板药物作用受体有潜在的影响。
以上机制或可解释一些临床试验中观察到的糖尿病患者体内血小板多具有高活性,需氯吡格雷剂量加倍才能达到有效抑制血小板聚集的目的。
3、临床因素:影响抗血小板治疗反应的临床因素有很多,包括用药剂量、服药的依从性等。依从性差的患者药物作用会比较差,这是一个普遍规律。一些临床相关因素可能影响患者基线状态下血小板活性,从而影响抗血小板治疗的反应,如ACS、糖尿病、肥胖、肾功能不全等。药物间相互作用也是影响抗血小板治疗反应性的重要因素,常见的如部分质子泵抑制剂和钙通道阻滞剂可干扰氯吡格雷在体内的活化,布洛芬可与阿司匹林竞争结合COX-1等,可能降低抗血小板疗效。但对于药物间相互作用是否能导致临床缺血事件增多,目前尚无充分的临床证据。
三、阿司匹林治疗反应多样性的临床检测建议
阿司匹林反应多样性的检测方法包括血栓素 (thromboxane,TX) A2代谢产物尿 11-脱氢 TXB2的测定、各种诱导剂(如花生四烯酸等)诱导的血小板聚集率测定、VerifyNow阿司匹林检测等。由于炎症等病理条件下,体内花生四烯酸除COX-1途径外,还可经COX-2途径代谢,目前多数方法测得的结果会受炎症、全身高反应性等因素影响,并不能反映阿司匹林的真实效果,可能导致阿司匹林治疗低反应或无反应的发生率被高估。
早期文献报道,阿司匹林治疗低反应患者择期 PCI 后围术期心肌坏死的风险较高反应患者增高 2.9 倍,长期临床缺血事件风险亦为高反应患者的 2.8-3.5 倍。但这些研究中,人选患者多数仪接受单一阿司匹林治疗,且阿司匹林治疗低反应的诊断标准多为非特异性,近年 ADAPT-DES、ASCET 等研究表明,在 PCI 术后接受双联抗血小板治疗的患者,阿司匹林治疗低反应与缺血事件并无关联。
建议:根据目前临床研究证据,已接受双联抗血小板治疗的患者,阿司匹林治疗反应对临床预后的判断价值尚不明确,不推荐常规筛查。
四、血小板P2Y12受体抑制剂治疗反应多样性的临床检测建议
(一)血小板P2Y12受体抑制剂治疗反应多样性的检测方法
目前国内常用的评价P2 Y12抑制剂疗效的方法包括:光学比浊法(LTA)、VerifvNow P2Y12检测、血管扩张刺激磷酸蛋白(VASP)、血栓弹力图(TEG)和Plateletworks类似产品。
1、LTA检测:最经典的血小板功能检测方法,常作为诊断性研究的金标准。常用诱导剂:花生四烯酸、肾上腺素、胶原等。其检测指标为血小板最大聚集百分比:过高提示抗血小板药物作用不佳,存在HPR,缺血风险增大;过低提示血小板过度抑制,出血风险增大。LTA的优点是价格低廉,易于推广普及,与临床事件相关性很好。缺点是血样处理及检测过程较繁琐,样本制备复杂,缺乏标准化流程,在国外已渐被方便快捷的床旁检测方法所取代。
2、VerifvNow P2Y12检测:属床旁检测设备,其检测指标为血小板反应性单位(P2Y12 reaction unit,PRU),临床意义与血小板聚集率相同。VPrifyNow的优势为采用全血作为标本,可重复性好,整个检测过程仪需3 min,在目前所有血小板功能检测方法中耗时最短、最方便易行。已有大量文献证实,VerifVNow的检测结果与LTA法及临床事件均有很好相关性。目前VerifvNow在国内检测费用较高,尚未普及,不过开展单位正在逐渐增多。
3、VASP检测:其检测结果被称为血小板反应性指数(platelet reactivitv index,PRI),目前多以PRI>50%作为氯吡格雷治疗低反应的诊断标准。VASP检测的优势在于P2 Y12信号通路的特异性,且较LTA法测定更为稳定。临床研究表明,根据VA SP检测定义的氯吡格雷治疗后,HPR与临床事件的相关性很好。其不足主要在于技术操作较复杂、样本制备复杂、需要流式细胞仪等设备、价格相对昂贵,在基层医院推广有困难。开展单位少,多用于研究。
4、TEG检测:主要检测指标为反应时间(R)及曲线最大振幅(MA),R反应凝血速度。MA反映血栓形成的强度,MA越大,血栓风险越高。TEC采用全血检测,除检测血小板功能外,还可了解纤溶系统功能,对血栓和出血风险均可进行评价。但其检测血小板功能的敏感性和特异性不如其他方法,且检测所需时间较长、价格较昂贵,以往多用于外科手术围术期。近年有文献报道,TEG血小板图不仅可检测血小板在凝血过程中的独立作用,还可缩短检测时间,其检测结果与LTA法有很好的相关性。
5、Plateletworks:原理类似于血小板计数仪,检测指标亦为血小板最大聚集百分比。其优点是采用全血标本,操作简便、快速、价格低廉。大样本POPULAR研究表明,Plateletworks检测结果与临床事件相关性较好,但其临床证据较少。对于Plateletworks,目前国内已有类似替代产品(PL-11),但临床证据较少,其结果解读需慎重。
上述检测方法中,VerifyNow P2 Y12和VASP检测因具有标准化操作方法而被欧美共识所采纳,但在国内普及率不高。LTA虽存在缺点,但根据我国国情,鉴于其价格低廉,对设备要求低,故仍有较大的应用空间。
建议:中国专家推荐有条件的中心应用VerifyNow或VASP检测评价P2 Y12抑制剂治疗反应,无条件的中心仍可采用 LTA法,但需注意操作标准化。
欧美专家共识(Eur Heart J.2014;35:209-215. J Am Coll Cardiol.2013;62:2261-73)推荐使用VSAP、VerifyNow和Multiplate(快速,全血检测,与临床事件相关性好,国内未引进和开展)。LTA由于缺乏标准化方法而不被推荐。
(二)P2 Y12抑制剂治疗反应性检测的预测价值和适用人群
目前已有大量临床研究结果表明,P2Y12抑制剂(特别是氯吡格雷)治疗后的HPR是PCI术后血栓事件的独立危险因素。ADAPT-DES研究表明,HPR者的早期和晚期支架内血栓风险分别为非HPR者的3.0和2.49倍。约60%的早期支架血栓事件可用HPR解释,其预测价值在 ACS 患者中更加明确。
但由于支架血栓是小概率事件(通常<3%),而HPR的发生率约为20%~40%,所以HPR对支架血栓仅具有中等程度的预测价值,敏感性和特异度均有限。目前较为统一的观点是,HPR不应被视为血栓事件的诊断标志,而应被看作血栓事件的危险因素。血栓事件的判断应结合血小板功能检测结果、临床和介入手术特点进行综合考虑。
对于稳定性心绞痛及ACS未接受PCl的患者,无证据表明HPR是临床事件的独立危险因素。ADRIE研究表明,稳定性冠心病患者的血小板功能与临床缺血事件无关联。TRILOCY -ACS研究纳入了未接受PCI的病情稳定的ACS患者。其血小板功能亚组分析表明,HPR不是主要临床缺血事件的独立危险因素,但由于研究本身存在较多缺陷(如血小板功能并非在血栓风险最高时测量等),对于ACS未行PCI的患者,其HPR对临床事件的预测价值还需进一步证实。
抗血小板治疗是减少慢性稳定性心绞痛患者再发事件和死亡的重要用药之一。建议:(1)下列ACS且接受PCI治疗的患者,建议行血小板功能检测以指导P2Y12抑制剂治疗方案:常规剂量氯吡格雷治疗时发生了支架血栓或血栓事件,如心肌梗死;临床和介入手术结果预测血栓风险明显增高(如肥胖、糖尿病、肾功能不全、术中出现夹层、无复流等);左主干、单支开放血管(左主干等同病变)、多支血管病变、桥血管病变及弥漫病变需多枚支架重叠置入等高危病变PCI术后。(2)未行PCI,且经药物治疗病情稳定的ACS或稳定性心绞痛接受非复杂PCI者,不推荐常规HPR筛查。
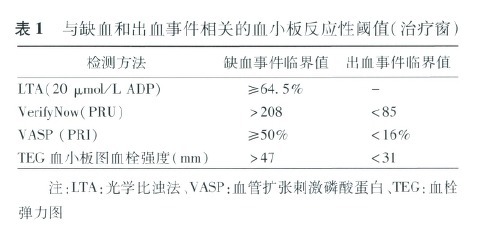
(三)血小板功能检测结果预测缺血和出血事件的临界值
临床研究结果表明,治疗后存在HPR者缺血风险增高;反之,血小板低反应性(LPR)者出血风险增高,提示抗血小板治疗可能存在治疗窗。近期欧美相继发表家共识,列举重要临床研究发现的一些对预测缺血和出血事件具有意义的临界值,旨在通过血小板功能检测结果指导抗血小板药物治疗,使其抗血小板作用保持在治疗窗内。该策略是否安全有效,还需更多临床证据支持。
需从患者整体评估缺血和出血风险。除血小板功能外,还须结合临床危险因素(如老年、贫血、糖尿病、体质指数、慢性肾功能不全、既往缺血/出血病史、合用抗凝药物、是否应用作用更强的P2Y12受体抑制剂如替格瑞洛等)进行综合评价。此外,考虑到族种、体质量、饮食结构等因素,预测中国人群缺血和出血事件的临界值可能与欧美国家不同,也需进行更深入的研究,从而建立适合中国人群的抗血小板治疗剂量和治疗窗。
(四)CYP基因型检测
氯吡格雷和普拉格雷均为前体药物,需经由肝脏CYP代谢酶的活性转化后方能发挥药效;而替格瑞洛本身就是活性药物,其代谢产物(经CYP3 A4/5代谢)亦具有生物活性。大量研究表明,携带CYP2C19 LOF等位基因会显著影响氯吡格雷的抗血小板反应性,但对普拉格雷和替格瑞洛无影响或影响较小。因此,CYP2C19基因型检测仅对评价氯吡格雷的治疗反应有较大价值。
基于众多临床研究结果,美国FDA(Food And Drug Administration)于2010年3月发布“警告”,提醒应用氯吡格雷后出现心血管不良事件与CYP2C19LOF等位基因表达有关。我国人群中CYP2C19 LOF等位基因携带者的比率约为欧美国家的2倍(56%:27%),但与来自欧美国家的数据相比,我国人群中CYP2C19*2 LOF等位基因杂合子比例很高(约为45%),此部分患者对氯吡格雷治疗的反应与非携带者相比并无明显减退;CYP2C19 *2LOF等位基因纯合子比例约为11%,其HPR及临床缺血事件风险均显著增高。
近年一些小样本探索性临床研究表明,根据CYP2C19基因型调整P2 Y12抑制剂治疗方案(增加氯吡格雷剂量或改用作用更强的替格瑞洛)可改善HPR,但能否提高临床获益还需进一步观察。
与HPR相同,虽然CYP2C19 LOF基因型是缺血事件的独立危险因素,但单独根据基因型预测缺血事件的价值较有限。有文献报道,基因型在氯吡格雷抗血小板治疗反应个体差异中所起的作用约为2%~12%。ARCTIC-GenP研究对1420例行支架置入治疗的患者做了CYP2C19基因型检测,将血小板功能检测与CYP2C19基因分析进行了比较,发现这两种检测方法所呈现的趋势并不一致。基因型检测呈“慢代谢型”的患者中,仍有较高比例(40. 27%)对抗血小板治疗反应良好;而在基因型呈“快代谢型”的患者中,亦有一定比例(30. 9%)治疗反应不佳。
单纯根据血小板功能检测或基因型分析结果,对缺血事件进行预测的效度均较低(ROC曲线下面积0.497~0.523),再次提示两者必须综合临床因素才可能获得较客观的评价。来自中国的药物洗脱支架术后ACS患者的数据显示,对于无或仅1个CYP2C19 LOF等位基因多态位点携带者,伴或不伴HPR时,其缺血事件发生率分别为16.7%和2.1%;而携带2个LOF等位基因多态位点的患者,伴或不伴HPR时,其缺血事件发生率分别达到29.5%和9.7%,提示在中国人群中,将血小板功能检测与基因型测定相结合可能提高缺血事件预测效能,但尚需大样本、多中心研究作进一步验证。
建议:(1)尚不能肯定基因多态性所致血小板反应性差异对个体临床结果的影响,不推荐常规进行CYP2C19基因型检测。(2)PCI术后血栓高危,且对计划改变P2Y12抑制剂治疗方案的患者推荐行血小板功能检测,建议同时行CYP2C19基因型检测,并根据检测结果调整抗血小板治疗方案。
五、血小板功能和(或)基因型检测指导的个体化抗血小板治疗
根据血小板功能和(或)基因型检测结果指导个体化的抗血小板治疗,以减少血栓和出血风险,理论上是一种理想的治疗策略,但迄今为止,并无充分临床证据证实这种策略的有效性。目前常用的个体化治疗策略包括以下几种:
1、调整阿司匹林剂量:CURRFNT-OASIS、HORIZONS-AM1、PLATO等研究的数据分析表明,应用P2Y 12抑制剂的情况下,增加阿司匹林剂量并不能改善临床事件,反而增加出血风险。
建议:在与P2 Y12抑制剂合用时,即使血小板功能检测结果提示阿司匹林治疗反应不佳,也不推荐增加阿司匹林剂量(超过 100 mg/d)。
2、调整氯吡格雷维持量:虽然早期的小样本临床研究表明,针对HPR患者增加氯吡格雷的维持量可有效改善HPR和(或)减少临床缺血事件,但近年来自GRAVITAS、ARCTIC等随机临床研究的结果表明,HPR患者接受高剂量(150 mg/d)氯吡格雷治疗并不能减少临床缺血事件发生率。
4ELFVATE-TIMI 56研究表明,稳定性冠心病患者,如为CYP2C19 LOF等位基因杂合子,给予3倍维持剂量氯吡格雷(225 mg/d)可获得与无CYP2C19 LOF等位基因患者接受75 mg/d相同的血小板抑制效果;而CYP2C19 LOF等位基因纯合子患者,即使将氯吡格雷维持量提高至300 mg/d仍无法获得有效的血小板抑制效果。ELEVATE-TIMI 56后续分析还发现,CYP2C19 LOF等位基因携带者中(含杂合子和纯合子),给予非糖尿病患者150 mg/d氯吡格雷治疗可起效;但对于糖尿病患者,氯吡格雷维持量需增加至300 mg/d方能起效。
建议:(1)对于常规剂量氯吡格雷治疗无反应或低反应者(即HPR),尤其是合并糖尿病的患者,不推荐首选增加氯吡格雷剂量,应优先采用新型P2Y12抑制剂替代治疗。(2)如存在出血高危因素,或因其他原因不能接受新型P2 Y12抑制剂治疗,可根据血小板功能、CYP2C19基因型和临床特点(如有无糖尿病等)增加氯吡格雷剂量。
3、其他P2Y12抑制剂治疗:PLATO等大样本随机对照研究证实,ACS患者PCI术后应用替格瑞洛的长期疗效明显优于氯吡格雷。一些小样本临床研究表明,对氯吡格雷治疗不敏感或CYP2C19基因型为中间代谢型和(或)慢代谢型的患者,在换用替格瑞洛治疗后,其血小板聚集亦可得到显著抑制。
2013年发表的欧洲心脏病学学会稳定冠心病治疗指南推荐稳定冠心病患者择期PCI后应首选氯吡格雷(I,A)。对于在氯吡格雷应用期间发生支架血栓(Ⅱa,C)或左主干、支架血栓高危、糖尿病等特殊患者(Ⅱb,C),可选用普拉格雷或替格瑞洛。
建议:(1)对于ACS接受PCI的患者,氯吡格雷和新型P2Y12抑制剂(如替格瑞洛等)均为一线用药,在实际选择时应充分权衡血栓和出血风险。对于临床和病变特点以及血小板功能、基因多态性检测结果提示缺血风险较高者,建议首选新型P2Y12抑制剂;而对于出血风险较高者(如高龄、卒中史、既往出血史、严重贫血或血小板数量和功能降低),建议首选氯吡格雷。(2)对于稳定性心绞痛接受非复杂PCI的患者,因血栓风险较低,推荐首选氯吡格雷。
4、双联治疗基础上加用西洛他唑:西洛他唑作为PCI术后抗血小板药物之一,在东亚国家的应用远多于欧美。许多研究表明,HPR患者在阿司匹林、氯吡格雷基础上加用两洛他唑后,可显著降低血小板反应性,但其临床获益还需进一步验证。
六、研究方向
迄今为止,几乎所有的研究均表明,根据抗血小板治疗反应调整治疗方案可显著改善 HPR状态,但针对这种实验室的获益能否转化为明确的临床益处尚存争议。其原因可能与多数研究设计本身的缺陷有关:(1)采用HPR作为入选标准,并未考虑基因检测及其他临床血栓高危因素,导致实际缺血事件发生率远低于预期,样本量相应不足而得出阴性结果。(2)治疗方案调整可能不尽合理,如双倍剂量的氯吡格雷对于CYP2C19 *2纯合子或杂合子的患者(尤其是合并糖尿病者)作用并不明显,以及干预治疗的时间不够长等。
今后的研究应着重注意以下方向:(1)基于大数据分析,探索适合中国人群的抗血小板药物、方案及治疗窗,构建更加综合全面的缺血风险评价量表,为临床抗血小板治疗决策提供依据。(2)开展高质量的多中心、大样本随机临床研究,改变以往单一采用HPR作为风险评价标准的做法,通过综合缺血风险评价入选更高危的患者,以探索优化抗血小板策略的有效性和安全性。(3)针对临床抗栓治疗决策困难的特殊人群(如高龄、糖尿病、肾功能不全等),开展更加细致深入的药效学、药代动力学和临床预后研究。
七、小结
1、对于已接受双联抗血小板治疗的患者,不推荐阿司匹林治疗反应检测。在与P2Y12抑制剂合用时,即使血小板功能检测结果提示阿司匹林治疗反应不佳,也不推荐增加阿司匹林剂量(超过 100 mg/d)。
2、P2 Y12抑制剂治疗反应监测推荐应用VerifyNow或VASP检测,无条件时可采用LTA方法,但需注意操作标准化。
3、P2Y12抑制剂治疗反应监测对于接受PCI的ACS患者意义较大,但不推荐常规使用,其适用人群为血栓高危患者,如:接受氯吡格雷治疗时发生了支架血栓;临床和手术结果提示血栓风险明显增高(如肥胖、糖尿病、肾功能不全、术中出现夹层、无复流等);左主干病变、单支开放血管、多支血管病变、桥血管病变及弥漫病变需多枚支架重叠等高危病变PCI术后。
4、对于未行PCI且经药物治疗病情已稳定的ACS患者,或稳定性心绞痛行非复杂PCI患者,不推荐常规HPR筛查。
5、不推荐常规CYP2C19基因型检测。对于PCI术后血栓高危且计划调整P2 Y12抑制剂治疗方案的患者,推荐行血小板功能检测,建议同时行CYP2C19基因型检测,并根据检测结果调整抗血小板治疗方案。
6、对于ACS接受PCI的患者,氯吡格雷和新型P2Y12抑制剂(如替格瑞洛等)均为一线用药,在实际选择时应充分权衡血栓和出血风险。对于血栓风险较高且常规剂量氯吡格雷治疗呈低反应者,建议首选新型P2Y12抑制剂。如因其他原因不能接受新型P2 Y12抑制剂治疗者,可根据血小板功能、CYP2C19基因型和临床特点增加氯吡格雷剂量。出血风险较高者,建议首选氯吡格雷。
7、对于稳定性心绞痛接受非复杂PCI的患者,推荐首选氯吡格雷。
- 评价此内容
- 我要打分
近期推荐
热门关键词
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号



 会员登录
会员登录

