2015NCCN结肠癌指南
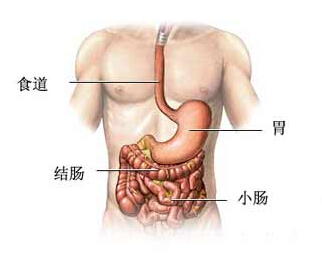
结肠癌是常见的发生于结肠部位的消化道恶性肿瘤,好发于直肠与乙状结肠交界处,以40~50岁年龄组发病率最高,男女之比为2~3:1。发病率占胃肠道肿瘤的第3位。日前,美国国家综合癌症网络(NCCN)对之前的指南进行了更新。
一.重要的更新内容:
1. 检测RAS基因状态,包括KRAS外显子2和非外显子2以及NRAS,还需检测BRAF基因状态,不论是否有RAS突变。
2. FOLFOX+Cetuximab作为治疗选择时需注意如下注释:对潜在可切除肝转移疾病的治疗数据仍有争议。
3. 对可切除的转移性疾病,围手术期总的治疗时间不超过6个月。
二.概述
美国的结直肠癌诊断位列第四,癌症导致死亡位列第二,数据显示发病率和死亡率呈下降趋势。发病率与死亡率的改善是癌症预防、早期诊断、更好治疗决定的。临床医生在使用指南时要明确以下几点:
1. 指南中分期按TNM分期;
2. 除非有特别标注,所有推荐级别均为2A。
三.风险评估
大约 20% 的结肠癌有家族聚集性,新诊断结直肠癌腺癌或腺瘤病人的一级亲属患结直肠癌风险增高。结直肠癌遗传易感性包括:明确定义的遗传综合征如林奇综合征和家族性腺瘤样息肉增生。推荐所有结肠癌病人要询问家族史及风险评估。
1. 林奇综合征是最常见的遗传性结肠癌易感综合征,占所有结直肠癌 2%-4%。由DNA错配修复基因(MMR)突变所致,包括MLH1、MSH2、MSH6 和 PMS2。NCCN支持对所有小于70岁病人或是大于70岁、满足 Bethesda指南的病人进行MMR检测。另外对II期病人也要进行检查。
2. 结直肠癌的其它风险因素
炎症性肠病患者结直肠癌风险增加,其它可能风险因素包括吸烟、红肉和加工肉类的食用、饮酒、糖尿病、体力活动少、代谢综合征、肥胖或高 BMI。吸烟、代谢综合征、肥胖或红肉和加工肉类的食用可能与预后差相关,结直肠癌家族史则预后相对好,数据尚有争论。
四.分期
第七版AJCC分期手册对结肠癌分期作了部分调整。II期疾病根据T3还是 T4,及T4侵犯程度分为 IIA和IIB、IIC。N1和N2 也进一步细分,反应受累淋巴结数量对预后的影响。浆膜下层、肠系膜、非腹膜的结肠周围或直肠周围组织肿瘤沉积定义为N1c。根据远处转移只局限于 1 个还是多个组织或器官,细分为M1a和M1b。
五.病理学
病理报告中应包括如下内容:癌症分级、穿透深度、向邻近器官延伸程度、区域淋巴结数量、阳性淋巴结数量、是否存在远处转移、远近端切缘及环周切缘情况、是否有淋巴血管侵犯、神经周围侵袭、结外肿瘤沉积。TNM分期中采用的“p”和“yp”分指病理分期、新辅助治疗和手术后的病理分期。
1. 边缘
直肠癌中环周切缘(CRM)是肿瘤浸润最深处、与肿瘤最近的外膜软组织,钝性或锐性分离后腹膜面产生。横结肠是全部由腹膜包绕的结肠,肠系膜切除边缘就是CRM。第七版 AJCC中建议外科医生应对切除完整性进行评估,R0 是肿瘤完全切除,边缘阴性;R1是肿瘤切除不完全,边缘有镜下阳性;R2是不完全切除,边缘有肉眼阳性。
2. 淋巴结
NCCN委员会推荐至少要检测12个淋巴结,对于T4损害检测更多的淋巴结会更合理。对诊断N0,但检测淋巴结数小于12个者认为是高危因素。
3. 结外肿瘤沉积
也称作肿瘤周围沉积或卫星结节,是肿瘤结直肠周围脂肪组织中肿瘤的分散沉积,不计入受累淋巴结总数中,沉积位置应属于原发肿瘤的淋巴引流区域。大多数沉积认为来自淋巴血管侵犯或是神经周围侵犯。结外沉积数目应录入病理报告,对DFS和OS有影响。
4. 神经周围侵犯
神经周围侵犯与预后差相关,是全身复发的高危因素。
六.维生素D在结直肠癌中的作用
有研究显示维生素D缺乏可能增加结直肠癌发生率,补充维生素D能降低结直肠癌风险。目前尚无研究检测补充维生素D是否能改善病人结果。由于尚缺乏高水平证据,委员会不推荐常规检测维生素D水平,也不推荐结直肠癌病人补充维生素 D。
七.小肠和阑尾腺癌
由于小肠和阑尾腺癌极罕见,目前尚无专有NCCN 指南。局部小肠腺癌可行手术切除,但局部和远处复发常见、恰当的围手术期治疗不明确。进展期小肠腺癌数据有限,可尝试CapeOX和FOLFOX 治疗。
八.非转移性疾病的临床表现和治疗
1. 恶性息肉的诊治
恶性息肉定义为癌症侵犯粘膜下层,息肉若是没有侵袭粘膜下层的原位癌不会出现区域淋巴结转移。内镜切除腺瘤性息肉或腺瘤后是否需要进一步手术切除,需要对病理学结果评估并咨询病人。
不论是有蒂还是无蒂息肉(腺瘤)内发现有侵袭性癌,如果切除完全,组织学特征良好,则无需再行手术。组织学特征良好包括 1 或 2 级、没有血管淋巴侵犯、切缘阴性。对完全移除、单个无蒂息肉、组织学特征良好、切缘阴性者也可行结肠切除,因为无蒂息肉负性结果的发生率明显增高,包括复发、死亡率和血行转移。
如果标本破碎、边缘无法评估,或是标本组织学特征不良,推荐结肠切除、淋巴结整块切除,也可选用腹腔镜切除。不良组织学特征包括 3 或 4 级、血管淋巴侵犯、阳性切缘。阳性切缘可以定义为横切缘的 1-2 毫米内存在肿瘤,或是热消融横断面内有肿瘤细胞。
所有切除息肉的病人应当进行全结肠镜检查以排除其它息肉,并进行内镜随访。I 期病人不推荐化疗。
2. 侵袭性非转移性结肠癌的诊治
对侵袭性结肠癌适合切除病人需仔细分期,包括病理评估、全结肠镜检、血常规、生化、CEA 以及胸腹及盆腔的基线增 CT。如果 CT 仍不能充分评估则考虑 MRI 增强。PET/CT 并非常规基线检查,但如果 CT 或 MRI 显示可疑异常又不能确定时可以考虑,尤其当结论可能会改变治疗策略时。小于 1 厘米损害不建议 PET/CT 检查。
如果是可切除的结肠癌产生了完全性肠梗阻,应行结肠切除并整块切除区域淋巴结,如果需要转流者可于转流或支架后再行结肠切除。支架通常用于远端损害,支架可以去除近端结肠压力利于择期结肠切除术吻合治疗。如果结肠癌局部不可切除或病人不能耐受手术,则推荐化疗,争取转化为可切除状态。
3. 可切除结肠癌的辅助化疗
辅助化疗获益良多,化疗选择主要依据疾病分期:
① I 期病人不需要任何辅助治疗
② 低危 II 期病人可入组临床试验,或是观察,或是考虑卡培他滨或 5-FU/LV 治疗。不推荐 FOLFOX 治疗没有高危因素的 II 期病人。
③ 高危 II 期病人,包括 T4、分化差(除外 MSI-H)、淋巴血管侵犯、神经周围侵犯、肠梗阻、穿孔或穿孔位置距肿瘤很近、不确定或阳性切缘,或淋巴结不足 12 个,都要考虑辅助化疗,方案包括 5-FU/LV、卡培他滨、FOLFOX、CapeOX 或 FLOX。不行化疗只进行观察也可考虑。
④ III 期病人推荐术后 6 个月的辅助化疗,化疗方案包括 FOLFOX(优选)、CapeOX(优选)、FLOX、5-FU/LV 和卡培他滨用于不适合奥沙利铂治疗的病人。委员会不推荐使用贝伐单抗、西妥昔单抗、帕尼单抗和依立替康用于非转移疾病的辅助治疗。
⑤ II 期病人伴有 MSI-H 时预后好,不会从 5-FU 辅助治疗中获益,委员会推荐 II 期病人应行 MMR 检查,分化差的病理类型如果伴有 MSI-H 则不认为是高危因素。
有研究显示化疗每延迟四周,OS会减少 14%,因此辅助化疗应当在病人可承受情况下尽早开始。
九.转移性疾病的治疗原则
50%-60% 病人会出现转移,80%-90% 病人出现不可切除肝转移。转移性疾病经常在区域性治疗后出现,肝脏是最常受累部位,20%-34% 病人为同时肝转移。肝转移病人若未接受手术则 5 年生存率低。一些临床病理因素如肝外转移、超过 3 个肿瘤、DFS 小于 12 个月者预后差。
1. 手术治疗结直肠癌转移
研究显示对选择性病人手术切除结直肠癌肝转移是可能治愈的,5 年无病生存可达 20%。结直肠癌还可发生肺转移,大多数推荐肝转移治疗策略也适用于肺转移,肝肺联合切除只适合高度选择的病人。还有数据显示对再次肝复发的转移病灶可再行手术切除,但 5 年生存率会随着每次手术而降低,手术时存在肝外疾病是独立的预后差因素。
对原发和转移灶同时可切除者可行同时切除或分次切除。对不可切除转移且原发肿瘤未出现急性梗阻时,姑息性切除原发灶是极少见的适应症,化疗是首选治疗。
2. 肝脏治疗
尽管可切除转移性疾病的标准治疗是手术切除,也可对某此病人进行肝脏局部非手术治疗。
3. 腹腔转移
大约 17% 的病人出现结直肠癌腹腔转移,2% 的病人只有腹膜转移,此种病人 PFS 和 OS 通常短于无腹腔转移的病人。治疗目的多为姑息。委员会警告,使用结直肠支架的病人接受贝伐单抗治疗增加穿孔风险。
4. 决定是否可切除
病人诊断为潜在可切除结直肠癌则应接受多学科评估,包括手术咨询以评估可切除状态。确定病人转移性疾病可切除的标准是能完全切除所有疾病且切缘阴性、保有充分肝功能。对残肝功能不足者可术前门脉栓塞受累肝脏以增加肝保留。需指出的单纯肿瘤大小并不是肿瘤切除的禁忌症,切除肝脏转移目的是治愈疾病,去块手术无获益。
5. 转化为可切除
大部分诊断转移的病人都是不可切除的疾病;但肝脏有限转移如累及关键结构,则肿瘤退缩后可行手术切除,这种病人要高度考虑化疗以减小转移灶,使其转化为可切除;肝脏或肺脏有多个转移者,单纯化疗不能获得 R0 切除,这种应认为不能转化的不可切除病灶。
任何用于治疗转移性疾病的化疗方案都可用于转化治疗,目的不是去除微转移灶而是试图获得肿瘤回缩。重要的是含伊立替康和奥沙利铂的方案可致肝脏脂肪性肝炎和窦性肝损伤。为减少肝毒性,推荐一旦手术可实行时要尽快执行。对初始不可切除疾病的化疗,委员会推荐再评估病情需每二个月一次。
6. 可切除疾病的新辅助和辅助性治疗
委员会推荐转移性病人接受切除术后应进行全身化疗,以去除残留病灶,围手术期治疗时间约 6 个月。术前、术后化疗方案选择依赖化疗史和反应情况、安全性,辅助和新辅助化疗推荐方案一致。如果肿瘤在新辅助化疗时继续生长,则换用其它方案或是观察。恰当的化疗顺序不清楚。可切除病人应先进行肝切除,然后行术后辅助化疗或是采用围手术期化疗。
术前化疗可能优势是:更早治疗微转移疾病、确定化疗反应,避免早期疾病进展病人行局部治疗。缺点是如果治疗中进展或是完全缓解,则可能错过了手术机会。所以术前化疗病人需频繁评估,多学科专家之间及病人间要密切沟通,优化术前治疗策略,恰当时机手术介入。术前化疗其它风险为肝毒性,故新辅助化疗最好限制在 2-3 个月。
7. 进展期或转移性疾病的化疗
治疗多发转移结直肠癌的药物既可联合应用也可单独应用,包括 5-FU/LV、卡培他滨、伊立替康、奥沙利铂、贝伐单抗、西妥昔单抗、帕尼单抗、阿柏西普和瑞格菲尼。治疗选择依据治疗目的、既往治疗类型和时间、治疗药物毒性。若病人体力状态等能耐受较强化疗,推荐如下五个方案之一:FOLFOX、FOLFIRI、CapeOX、5-FU/LV 或 FOLFOXIRI。
8. 同时转移性疾病的治疗
对怀疑有结肠腺癌转移的病例应进行充分检查,包括 RAS,野生型者考虑 BRAF 检测。不推荐常规 PET/CT,某些潜在手术可治愈病人可选,目的是确定是否还有其它转移灶;也不用于评估化疗反应,因为化疗后可有暂时阴性结果,还可因为感染或手术炎症而形成假阳性。
潜在手术可治愈标准中包括那些经过术前化疗转化为可手术治愈的病人。对大多数存在肝外转移的病人不存在治愈性切除可能,转化性切除更适合仅限于肝转移的病人。
9. 非同时转移性疾病的治疗
对转移疾病的检查包括增强 CT 或 MRI,PET/CT 也可考虑以快速明确有无其它肝外转移灶,确定 RAS 状态,考虑 BRAF 检测。治疗非同时转移性疾病不同于同时转移性疾病,可切除者的治疗包括切除并行 6 个月围手术期化疗,方案根据既往化疗史选择。
对无化疗史者 FOLFOX 或 CapeOX 为优选方案,FLOX、卡培他滨和 5-FU/LV 也可选。有一些病例不推荐围手术期化疗,特别是奥沙利铂化疗史者可切除后选择观察,对新辅助治疗中生长的肿瘤观察也是恰当的选择。对不可切除的疾病要行化疗,对只有肝转移者 HAI 治疗可选 。对接受姑息化疗的病人应每 2-3 个月进行一次 CT 或 MRI 评估。
十、结肠癌辅助治疗标准
◆ 对于III期结肠癌患者来说,FOLFOX方案优于5-FU/亚叶酸钙,卡培他滨/奥沙利铂优于推注5-FU/亚叶酸钙,FLOX是FOLFOX或者CapeOx的一种替代选择,但是FOLFOX或者CapeOx优先选择。
◆ 在III期结肠癌患者中,卡培他滨与推注5-FU/亚叶酸钙似乎是等效的。
◆ 在II期结肠癌中,将奥沙利铂添加至5-FU/亚叶酸钙还未证明取得生存期获益。FOLFOX方案针对高危II期结肠癌是合理的,但是对于一般风险的II期结肠癌没有提供获益情况。
◆ 70岁及以上的患者中,5-FU/亚叶酸钙增加奥沙利铂的获益尚未证明。
◆ 贝伐珠单抗,西妥昔单抗,帕尼单抗或者伊立替康不能被应用于II期或者III期结肠癌患者临床试验之外的辅助治疗中。
十一、晚期或者转移性结肠癌化疗方案
1、适合强化治疗患者的化疗方案
2、不适合强化治疗患者的化疗方案
初始治疗:
①输注5-FU+亚叶酸钙或卡培他滨±贝伐珠单抗;
②或西妥昔单抗(只针对KRAS/NRAS WT基因);
③或帕尼单抗(只针对KRAS/NRAS WT基因)
初始治疗后:功能状态得到改善→考虑“适合于强化治疗的患者化疗方案”初始治疗;
十二.治疗后监测
治愈性手术和辅助化疗后,应进行治疗后监测,包括评估可能的治疗并发症、发现潜在可切除的复发、鉴定新的处于非侵袭阶段的肿瘤。研究显示 95% 的复发发生在 5 年内。目前对不同分期病人采取的监测强度仍有争议。长期随访可能的危害包括放射线暴露、不停随访及假阳性结果造成的心理压力。
I 期病人委员会推荐 1 年、3 年时行结肠镜检,然后每 5 年镜检一次,除非发现进展期腺瘤(绒毛状息肉、息肉>1 厘米、或高级别异常增生)时应每年进行一次结肠镜。
对 II/III 期成功接受治疗后的病人委员会推荐每 3-6 个月进行一次病史询问和体检,共 2 年;然后每 6 个月一次共 3 年。CEA 检查推荐基线时、每 3-6 个月一次 2 年、每 6 个月一次 3 年。
II/III 期患者结肠镜推荐切除术后 1 年(或术前因阻塞未进行者应术后 3-6 个月进行一次)、3 年,然后每 5 年进行一次,除非发现进展期腺瘤(绒毛状息肉、息肉>1 厘米、或高级别异常增生)时应每年进行一次结肠镜。对小于 50 岁患者应进行更为频繁的结肠镜检。对有林奇综合征的病人镜检频度要更高。
胸、腹及盆腔 CT 推荐每年一次,共 5 年,主要适用于高复发风险的 II/III 期患者。5 年后不推荐常规监测 CEA 及 CT 检查,PET/CT 不是理想的常规监测检查。结肠镜检主要鉴定和移除非同时发生息肉,因为具有结肠癌病史者发生二重癌风险增高,特别是切除后 2 年内。CT 用于监测是否存在潜在可切除的转移性疾病,主要是肺和肝。
对 IV 期接受了治愈性治疗的病人监测同 II/III 期病人,但某些检查要更频繁,委员会推荐胸、腹及盆腔增强 CT 在辅助治疗后的最初 2 年里要每 3-6 个月一次,然后每 6 个月一次 3 年,常规 PET/CT 不推荐。
对病人 CEA 增高应进行结肠镜检,胸、腹、盆腔 CT、体检,也可考虑 PET/CT 检查。如果影像学正常,而 CEA 不断升高,重复 CT 检查每 3 个月一次,至发现疾病或是 CEA 水平稳定或下降。研究显示 R0 切除后一半的 CEA 增高是假阳性,当 CEA>35ng/ml 时通常为真正阳性。
十三.总结
委员会认为多学科合作管理结直肠癌是必要的,支持在临床试验条件下治疗病人。可切除结肠癌的手术是整块切除和充分的淋巴结切除。对切除淋巴结进行充分病理评估很重要,至少要评估 12 个淋巴结。
FOLFOX 或 CapeOX 在辅助性治疗中优选;FLOX、5-FU/LV 或卡培他滨可用于 III 期病人;辅助治疗可用于 II 期高危病人;具有肝或肺转移病人如果能切除应考虑手术切除,术前化疗可作为初始治疗用于同时或非同时可切除的转移性疾病;如果病人可能对化疗有反应,从不可切除转化为可切除,就应启动治疗;在肝或肺转移切除后应考虑辅助化疗。
对弥漫转移性疾病应考虑连续治疗,启动治疗时要考虑的原则包括预先计划好的改变治疗时的策略。初始治疗选择要考虑病人是否能耐受强治疗,较强的初始治疗包括 FOLFOX、FOLFIRI、CapeOX 和 FOLFOXIRI,也可加入生物制剂。
术后监测包括 CEA、CT 和结肠镜,并应对长期副作用进行管理,便于疾病预防,促进更健康的生活方式。
- 评价此内容
- 我要打分
近期推荐
热门关键词
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号

 会员登录
会员登录

