李维勤副主委:从指南变迁看重症急性胰腺炎进展
一、概述
急性胰腺炎(acute pancreatitis, AP)是指多种病因引起的胰酶激活,继以胰腺局部炎症反应为主要特征,由激活的胰酶继而产生的炎症介质波及全身器官,伴或不伴有全身其他器官功能改变的疾病。AP在世界范围内是最常见的需要紧急收治入院的消化系统疾病之一,年发病率每10万人口13~45例。在美国每年因急性胰腺炎入院的患者达27万人次,总花费超过25亿美元。AP中大多数患者,病程呈自限性,预后较好,20%左右为重症患者,临床经过凶险,病死率高达30%。重症急性胰腺炎是重症监护病房(intensive care unit, ICU)常见的急危重症,疾病早期的全身炎症反应综合征(systemic inflammatory response syndrome, SIRS),以及后期胰腺坏死感染所导致的脓毒症和器官功能衰竭均需在ICU内治疗,ICU是重症急性胰腺炎治疗的重要组成部分。
1971年德国Martin Gülzow教授发布了第一个可考究的急性胰腺炎诊断和治疗指南,随后英国、意大利、美国等国家以及国际胰腺病联盟、国际胃肠病学会等多个学术机构陆续发表了各自的指南,有力地推动了重症急性胰腺炎的诊断和治疗。与此同时,重症急性胰腺炎是牵涉多学科的疾病,不同学科、不同地区医生对该疾病的认识相去甚远,为统一认识以便于国际间交流,1992年由Edward L Bradley Ⅲ教授倡导举行了亚特兰大国际急性胰腺炎研讨会,形成了著名的急性胰腺炎亚特兰大分类标准,此后一直沿用并奉为经典。
近年来,随着该领域理论和实践的迅速发展,相关概念、分类和治疗都有重大的变化,2013年初发表在GUT上的《2012版急性胰腺炎分类:亚特兰大国际共识的急性胰腺炎分类和定义的修订》,对相关概念做了修订,2013年7月,美国胃肠病学会(American College of Gastroenterology,ACG)发表了急性胰腺炎的管理指南,国际胰腺协会(International Association of Pancreatology,IAP)与美国胰腺协会(American Pancreatic Association,APA)也同时推出了最新版急性胰腺炎处理循证医学指南(IAP/APA指南),两个指南各有侧重点,推荐强度和证据质量均采用GRADE系统。以上三个文件内容代表了当前对急性胰腺炎定义、诊断和处理的最新进展。本文回顾历史上重症急性胰腺炎治疗的演变,结合最新指南推荐的变化,重点介绍诊断和分类标准、病情严重度评估、ICU处理和外科手术等方面的变化趋势。
二、急性胰腺炎的诊断和分类标准的变化
AP的诊断和分类伴随着人们对病理生理的认识及其治疗的进步而不断演变。1963年在法国马赛召开第一届国际胰腺炎研讨会,将胰腺炎分为急性胰腺炎、复发性急性胰腺炎、复发性慢性胰腺炎和慢性胰腺炎4大类。1984年在马赛召开第二届国际胰腺炎研讨会,同年在剑桥召开另一国际胰腺炎讨论会,这两个会议均废止了急性复发性胰腺炎和慢性复发性胰腺炎的名称,在病理学上认识到轻度胰腺炎为间质性水肿,可以发展为坏死性。
1992年国际急性胰腺炎专题研讨会制定的AP分级和分类系统(亚特兰大标准),对规范AP的诊断和治疗产生了重大影响。该标准将AP分为轻型胰腺炎(mild acute pancreatitis, MAP)和重症胰腺炎(severe acute pancreatitis, SAP)。MAP:仅引起极轻微的脏器功能紊乱,临床恢复顺利,没有明显腹膜炎体征及严重代谢紊乱等SAP的临床表现;SAP:指AP伴有脏器功能障碍,或出现坏死、脓肿或假性囊肿等局部并发症,或两者兼有。同时将局部并发症分为:急性液体积聚(acute fluid collection),胰腺坏死(pancreatic necrosis),急性胰腺假性囊肿(acute pseudocysts),胰腺脓肿(pancreatic abscess)。
亚特兰大标准简便、易行,对AP及其并发症提供了清晰的临床定义,完善了治疗体系,为国际间的临床研究和数据比较提供了明确的框架,是迄今为止最为广泛接受的AP分级和分类系统。但随着20年的实践和认识的深入,也逐渐显露出其缺点,SAP的比例有被“过度评估”的趋势,局部并发症的定义不够完美。
2007年,美国哈佛医学院等11个国家和地区胰腺研究组织着手对亚特兰大标准进行修订,并于2013年发表在GUT上——《2012版急性胰腺炎分类:亚特兰大国际共识的急性胰腺炎分类和定义的修订》。相关定义如下:
1.AP的诊断标准 临床上符合以下3项特征中的2项,即可诊断为AP:①与AP符合的腹痛(急性、突发、持续、剧烈的上腹部疼痛,常向背部放射);②血清淀粉酶和(或)脂肪酶活性至少高于正常上限值3倍;③增强CT、MRI或腹部B超发现AP征象。
2.AP的分类 分为三类,即轻型急性胰腺炎、中度重症急性胰腺炎和重症急性胰腺炎。
(1)轻型急性胰腺炎:特点是不伴有器官功能障碍及局部或全身并发症,不需特殊干预可自行缓解,死亡非常罕见(<3%),占AP的大多数(80%左右)。
(2)中度重症急性胰腺炎(moderately severe acute pancreatitis, MSAP):伴有一过性的器官功能障碍(48小时内可自行恢复),或伴有局部或全身并发症而不存在持续性的器官功能障碍(48小时内不能自行恢复)。MSAP的病死率远低于SAP。
(3)重症急性胰腺炎SAP(表1):必须伴有持续的器官功能障碍。持续的器官功能障碍定义为超过48小时以上的、不能自行恢复的器官功能障碍,涉及的器官仅限于呼吸系统、心血管和肾脏。

3.局部并发症的定义急性胰腺炎的局部并发症主要有4个:急性胰周液体集聚(acute peripancreatic fluid collection, APFC)、胰腺假性囊肿、急性坏死集聚(acute necrotic collection, ANC)、包裹性坏死(walled-off necrosis, WON),其他局部并发症还可能有胃排空功能不全(胃输出道梗阻)、脾静脉及门静脉栓塞、结肠坏死。
(1)急性胰周液体集聚(APFC):APFC发生在急性间质水肿性胰腺炎早期阶段,在CT图像上可见均质的、无包膜的液体,大多数APFC可以被自发吸收,不需特殊处理,少数会发展为胰腺假性囊肿。
(2)胰腺假性囊肿:胰腺假性囊肿是由APFC演变而来的,有完整的包膜,内容物无坏死组织等实体组织,如果有胰腺或胰周坏死组织,则称为包裹性坏死(WON)。从起病到假性囊肿形成一般至少需要4周时间。
(3)急性坏死集聚(ANC):在急性坏死性胰腺炎起病的前4周,胰腺或胰周坏死组织以及周围的液体,统称为ANC,以区别于APFC。在急性胰腺炎起病的第1周,ANC很难与APFC鉴别,因为很难判断有无胰腺或胰周组织坏死,但1周后一旦确定有胰腺或胰周组织坏死,则应称为ANC,而不是APFC。ANC可能会继发感染。
(4)包裹性坏死(WON):ANC经过炎症包裹形成完整有包膜的WON大约需要4周时间,WON也可能会继发感染。
与亚特兰大标准(1992)相比,新的标准对急性胰腺炎局部并发症和全身并发症的定义、病情严重度的判断和分类做了较多修改,更加科学、实用、可行,对指导急性胰腺炎的治疗及其他外科重症疾病的治疗都起重要作用。
三、SAP病情严重度评估与危险度分层的进步
SAP病情的变化迅速,病情凶险,单凭临床经验难以估计,严重度的评估有利于判断病情,指导是否入住ICU或转诊等临床治疗,也是国内和国际间学术交流的必备临床资料。严重度评估十分重要。20多年来,急性胰腺炎的严重度评估有了很大的发展。经历了3个阶段,即全身评分、局部评估、炎症反应和多器官功能评分。
(1)全身评分系统:包括Ranson评分,包括入院时的5项临床指标和入院48小时的6项临床指标,合计11分。当评分在3分以上时,即为重症胰腺炎,需要做灌洗治疗。Imrie评分是在Ranson分基础上的改良,在入院48小时作评分,包括白细胞计数、血糖、血尿素、氧分压、血钙、肝功能等8项指标,其特点是包含了血浆白蛋白浓度。但由于Ranson评分和Imrie评分都是根据患者入院24小时或48小时内的病情,不能动态估计严重度,而且评分未包括患者以往的身体状况。APACHEⅡ评分评估重症胰腺炎严重度评估的优点是,不但有急性指标和年龄参数,还有慢性健康评分,其次是不受入院后的时间限制,可反复评估,达到动态观察、监测疾病过程的目的,1992年亚特兰大标准,将APACHEⅡ评分在8分或8分以上规定为重症胰腺炎,并且可在病程的任何时间内应用。
(2)局部严重度评估,最初有人采用胰腺坏死组织评估方法和腹腔渗液的量和颜色方法评估。80年代开始,动态的增强CT扫描成为判断胰腺坏死的金标准,在众多给予CT的评分中,Balthazar评分被最广泛接受,包括了胰腺和胰外的病变,定量较为准确,评分方法简单易掌握,因而具有代表性。
(3)多器官功能不全与炎症反应评分系统:近年来的研究发现,过度炎症反应和多脏器功能障碍是影响患者预后的最重要因素之一,全身评分系统和局部评分系统无法准确反映多器官功能障碍SAP的病死率。APACHEⅡ评分中包括部分脏器功能指标,如血肌酐、心率、Glasgow评分等,但也未能代表完整的器官功能,需要针对多脏器不全SAP患者进行全面器官功能评估。器官功能衰竭的评分系统非常多(如AOSF评分、MOF评分、OSF评分等),但这些评分都是针对终末期患者,不适合早期重症胰腺炎的器官功能评估。当前较广泛应用的是Marshall的MODS评分和SIRS标准。MODS评分系统用6个器官系统的简单生理指标来反映器官功能,这些器官是肺、肾、肝、心血管、血液学和神经系统。
SIRS定义曾被批评过于宽泛,但近年的研究显示对于SAP早期患者而言,是较好的预后指标。SIRS定义为以下4项指标中出现2项或以上者:①体温<36℃或>38℃;②心率>90次/分;③呼吸频率>20次/分;④白细胞计数<4×109/L或>12×109/L或未成熟粒细胞>10%,SIRS状态持续48小时以上与急性胰腺炎多器官功能衰竭和死亡率相关。持续48小时以上的器官功能衰竭是急性胰腺炎患者死亡的关键因素。急性胰腺炎持续SIRS的死亡率(25%)明显高于一过性SIRS(8%)。持续SIRS状态对于急性胰腺炎死亡的判断灵敏度为77%~89%,特异度为79%~86% ;而入院SIRS状态对死亡的判断灵敏度为100%,特异度为31%。1992年亚特兰大标准缺乏脏器功能和炎症反应指标,同时所用评分缺乏胰腺炎的特异性,在最新的指南中已部分得到了修订,并提供了临床判断预后的策略,具有良好的可操作性(表2)。
2013年ACG指南推荐:
1)一旦确诊,立即进行血流动力学评估,必要时开始复苏(强烈推荐,中等级别的证据质量)。
2)进行风险评估将患者分为高风险组和低风险组,从而帮助分诊,比如收入ICU(有条件的推荐,低级别的证据质量)。
3)对于合并有器官衰竭的患者应尽可能收入ICU或者过度监护病房(强烈推荐,低级别的证据质量)。

2013 IAP/AP指南推荐:
1)全身炎症反应综合征(SIRS) 对于判断急性胰腺炎患者入院时及入院后48小时病情严重程度最佳。(2B级, 低度共识)
2)急性胰腺炎患者入院时判断预后的最佳策略:入院后建议行如下3项评估:①患者风险因素评估(如:年龄、合并症、体重指数等);②临床风险分层(如:持续性SIRS状态);③监测其对初始治疗的反应(如:持续性SIRS状态、血尿素氮、血肌酐)。(2B级,高度共识)
最新指南之所以推荐SIRS或持续性SIRS状态作为判断急性胰腺炎严重程度的指标(而非其他评分预测系统),是由于其高度的实用性,简便及可以重复检测。其他评分系统(如:APACHEⅡ, Ranson及改良Glasgow评分),也包括单一的血清学指标(C反应蛋白、血细胞比容、原降钙素、血尿素氮等),均未显示其明显优于或劣于SIRS或持续性SIRS状态这一指标。
2013 IAP/AP指南推荐的临床预后判断策略,既考虑了病情严重度、患者个体化情况和初始治疗的反应,也强调了对病情的再评估以指导后续治疗,更科学、更符合临床实践。
四、重症急性胰腺炎的ICU初始管理
1.ICU收治指征2013 IAP/APA指南推荐ICU收治指征包括:当患者入院后确诊急性胰腺炎,参照“重症医学学会(Society of Critical Care Medicine ,SCCM)”指南定义,出现如下1个或以上指标阳性,应立即转入ICU治疗:①脉率<40次/分或>150次/分;②动脉收缩压<80mmHg(<10.7kPa)或平均动脉压<60mmHg(<8.0kPa)或动脉舒张压>120mmHg(>16kPa);③呼吸频率>35次/分;④血清钠<110mmol/L或>170mmol/L;⑤血清钾<2.0mmol/L或>7.0mmol/L;⑥PaO2<50mmHg(<6.7kPa);⑦pH<7.1或>7.7;⑧血糖>800mg/dl(>44.4mmol/L);⑨血钙>15mg/dl(>3.75 mmol/L);⑩无尿;⑪昏迷状态。此外,符合修订版亚特兰大标准定义的重症急性胰腺炎患者(如:持续存在器官功能衰竭)应收住ICU治疗。(1C级,高度共识)
新的指南不建议依据单一指标常规检查(如:C反应蛋白、血细胞比容、BUN或原降钙素)来决定患者是否收住ICU。如果患者存在病情恶化的高度风险,如持续SIRS状态、老年患者、肥胖患者、需持续性液体复苏,以及新亚特兰大标准的中度重症急性胰腺炎患者均应当收住过度重症监护病房(如:HDU)。
2.液体复苏液体复苏是急性胰腺炎早期重要治疗措施之一,有研究表明,SAP早期液体复苏能显著降低过度炎症反应和器官功能衰竭发生率,并能降低在院死亡率。因此,2013 IAP/APA指南推荐:急性胰腺炎患者行早期液体复苏(入院后首个24小时内)与持续SIRS状态/器官功能衰竭发生率下降相关。(1C级,高度共识)。
2013 ACG指南推荐:
1)积极液体复苏,即提供给每个患者250~500ml/h等张晶体液,除非有心血管、肾脏或其他相关并存疾病因素存在。早期积极的液体复苏在最初的12~24小时内最有效,超出这个时间窗可能就无效了。(强烈推荐,中等级别的证据质量)
2)液体丢失严重的患者,表现为低血压、心动过速,可能需要更加快速(弹丸式)地补液。(有条件的推荐,中等级别的证据质量)
3)乳酸林格液可能是首选的等张晶体代替液。(有条件的推荐,中等级别的证据质量)
4)在入院后6小时以及接下来的24~48小时,应反复评估患者的液体需求。积极的液体复苏的目的是降低血尿素氮水平。(强烈推荐,中等级别的证据质量)
2013 IAP/APA指南推荐:
1)急性胰腺炎首次液体复苏推荐使用平衡液(Ringer’s lactate)。(1B级,高度共识)
2)对于首次液体复苏,应采用5~10ml/(kg•h)的速度进行静脉输注,直至达到复苏目标。(1B级,低度共识)
3)判断患者对于首次液体复苏的反应基于如下指标中的1项或以上:①非侵袭性指标:心率<120次/分,平均动脉压65~85 mmHg (8.7~11.3kPa)及尿量>0.5~1 ml/(kg•h);②侵袭性指标:每搏输出量的变化和胸腔内血容量测定;③生化指标:血细胞比容35%~44%。(2B级,低度共识)
尽管也有RCT研究证据显示,急性胰腺炎在常规液体复苏基础上加用羟乙基淀粉(HES)可减少输液量,减少腹腔压力,对患者可能有益,但近年来多项RCT研究比较了羟乙基淀粉(HES)和平衡液(Ringer’s lactate)用于脓毒症患者液体治疗的效果,结果表明,羟乙基淀粉显著增加了肾衰竭发生率和死亡率,因此,目前临床对羟乙基淀粉的液体治疗持谨慎态度,两个新的指南都未推荐使用。仅有少数文献研究了不同晶体对于急性胰腺炎治疗结果的影响,在一项涵盖40名急性胰腺炎患者的多中心RCT研究中,液体复苏选用平衡液(Ringer’s lactate)较之普通生理盐水减少了SIRS的发生率。需注意的是新的研究关注到高氯浓度晶体可能与重症患者肾功能损害有关,因此,目前倾向使用平衡盐溶液。
对大多数急性胰腺炎患者而言,在第一个24小时内输注2500~4000 ml液体足以达到复苏目标。有2项RCT研究表明,过度的液体治疗会增加并发症发生率及死亡率。第一项研究发现,采用5~10ml/(kg•h)的速度进行静脉输注的患者,其机械通气比例、腹腔室隔综合征和脓毒症发生率及死亡率较之采用10~15ml/(kg•h)的速度进行静脉输注的患者为低。在第二项研究中,一组患者采用缓慢输液使得血细胞比容在48小时内保持35%以上,其较之另一快速输液组(血细胞比容在48小时内降至35%以下)在脓毒血症和死亡率方面均有减少。由于年龄及合并症(如:心衰)等个体化因素,指南对上述液体输注速率提出必须充分警惕并考虑个体差异。
如何监测和判断SAP液体反应性是另一个难点:最近有研究关注血尿素氮作为急性胰腺炎预后的判断指标,但该指标不能用作评估患者对于液体复苏的反应,对于生化指标(如:血细胞比容、血尿素氮)不应仅关注其绝对值,而要同时关注其变化趋势。由于SAP患者存在腹腔高压的因素,传统的压力监测指标都存在问题,最近一项研究显示,仅凭中心静脉压这一粗略指标来判断患者是否复苏完全是不可靠,有学者认为必须针对腹腔压力进行校正,近年发展的功能血流动力学指标初步显示出有较好的优势。但总体来说,多参数完整评估替代单一参数更为可靠。
3.腹腔室隔综合征(abdominal compartment syndrome,ACS)的治疗腹腔高压是急性胰腺炎的常见病理生理变化和并发症,腹内压是指稳定状态下的腹腔内压力。腹腔室隔综合征(abdominal compartment syndrome,ACS)是指持续性的腹腔内压力>20mmHg(伴或不伴腹主动脉灌注压<60mmHg),与新发器官功能衰竭相关。
腹腔高压需要进行客观的测定。目前推荐方法是在膀胱内灌注最大量25ml的生理盐水。行机械通气的重症急性胰腺炎患者尤其在当临床病情恶化时,应考虑行腹腔内压力测定。腹腔内高压(intra-abdominal hypertension, IAH)定义为持续或反复出现的腹腔内压力升高,压力值>12mmHg。据报道,有60%~80% 的重症急性胰腺炎患者会出现IAH,但只有一部分会演变为ACS。IAH分级如下:Ⅰ级:腹腔内压力12~15 mmHg;Ⅱ级:16~20 mmHg;Ⅲ级:21~25mmHg;Ⅳ级:>25mmHg。在一个小型的前瞻性队列研究中,重症急性胰腺炎患者伴有IAH及ACS,与肠道屏障功能衰竭及内毒素水平明显增高有关。
急性胰腺炎伴ACS的内科治疗:降低腹腔内压力的措施应针对导致IAH的最主要因素,包括:①空腔脏器容量:鼻胃管引流,促进胃肠道动力,放置肛管,必要时行内镜减压;②血管内/外液:按需行容量复苏,若容量过负荷可行血液超滤或利尿;③腹壁扩张:充分镇静镇痛以降低腹壁肌肉张力,必要时行神经肌肉阻滞。
急性胰腺炎伴ACS的外科治疗:当患者存在持续性腹腔内高压(>25mmHg)伴有新发器官功能衰竭,应用药物治疗、鼻胃管/肛管减压等措施无效,经过多学科讨论后可行侵袭性减压操作。侵袭性操作方法包括经皮穿刺置管引流腹水,经腹正中线或双侧肋缘下切口剖腹术,以及经皮下腹白线筋膜切开术。行外科减压时,腹膜后腔及网膜囊应保持完整以减少胰腺及胰周感染性坏死的风险。(2C级,高度共识)
尽管重症急性胰腺炎时行减压以治疗ACS的情况少见,但其可能是挽救生命的措施。目前缺乏ACS时外科减压与其他疗法间比较的RCT研究。一项2013年的国际IAH/ACS指南探讨了含急性胰腺炎在内的不同条件下ACS的流行病学及病因,提供了以循证医学为基础的诊断及治疗措施。指南指出,由于剖腹手术明显存在弊端,针对ACS及CT发现大量腹腔积液的患者应当考虑行经皮穿刺置管引流。经皮穿刺置管引流能即刻并持续地改善病情,如无效再行开放手术减压。为避免开放手术带来的不良后果如肠切除、液体丢失及感染,行开放手术后可考虑先采用补片移植物覆盖切口。
五、重症急性胰腺炎胰腺坏死感染的预防
1.预防性抗生素的作用多年来抗生素应用通常是重症急性胰腺炎感染预防的主要手段。但其实际效果多年来一直存在争议。早年多个研究结果显示,预防性抗生素使用可以降低感染的发生率和死亡率。既往指南推荐急性坏死性胰腺炎常规使用抗生素预防感染,而且推荐碳青霉烯类抗生素早期、足量和长程使用。然而,2007年Dellinger EP等报告了在北美和欧洲32个中心的随机双盲,比较美罗培南与安慰剂对照的临床研究,结果显示,重症的坏死性胰腺炎预防性应用碳青霉烯类抗生素并不能预防感染的发生。
2013 ACG指南推荐:
1)存在胰外感染的情况下应使用抗生素,比如胆管炎,导管获得性感染,菌血症,尿路感染,肺炎(强烈推荐,中等级别的证据质量)。
2)不推荐重症急性胰腺炎患者常规使用预防性抗生素治疗(强烈推荐,中等级别的证据质量)。
3)不推荐无菌性坏死的急性胰腺炎患者使用抗生素预防坏死组织感染的发生(强烈推荐,中等级别的证据质量)。
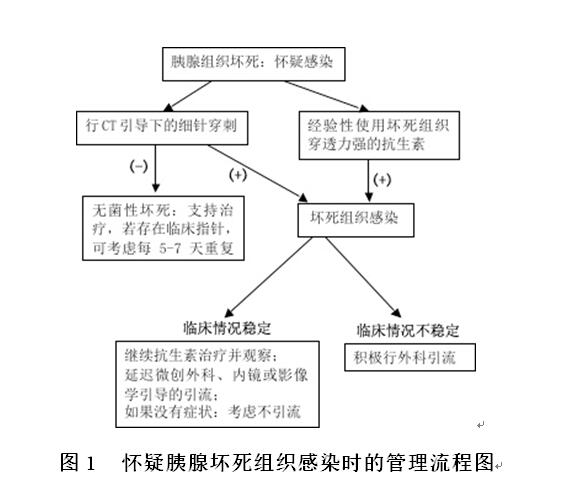
4)对于存在胰腺或胰外坏死患者,如果出现病情加重或者入院后7~10天病情无改善则应考虑坏死组织感染的发生。对于这类患者:①行CT引导下细针穿刺,穿刺液进行革兰氏染色和培养,依据结果指导抗生素的合理使用,具体流程见图1;②若为没有CT引导下的细针穿刺治疗,则考虑在获得必需的感染原谱以后行经验性抗生素治疗(强烈推荐,中等级别的证据质量)。
5)对于坏死组织感染的患者,能很好渗透胰腺坏死组织的抗生素,如碳青霉烯类、喹诺酮类和甲硝唑,也许可延缓行介入性操作,有时甚至可完全避免介入性操作,从而降低发病率和病死率(有条件的推荐,中等级别的证据质量)。
6)不推荐与预防性或治疗性使用抗生素一起常规行抗真菌治疗(有条件的推荐,低级别的证据质量)。
2013 IAP/APA指南推荐:
在急性胰腺炎时,不推荐静脉预防性应用抗生素以防止感染并发症。(1B级,高度共识)
最新指南尽管作为高度共识,不推荐在急性胰腺炎时静脉预防性应用抗生素以防止感染性并发症,但是在实践中,对于坏死性胰腺炎怀疑有感染及准备行进一步外科处理时,应当静脉使用抗生素。
2.选择性肠道去污的重新评价通常认为胰腺坏死感染的细菌来源于肠道,选择性肠道去污(select intestinal decontamination,SDD)被认为是预防SAP感染的重要途径。Luiten等于1990~1993年间,将来自16家医院的102个重症急性胰腺炎患者,随机分为标准治疗组和SDD组,采用口服和直肠给药(多黏菌素E、两性霉素和诺氟沙星)的途径肠道去污。结果发现SDD组死亡率明显下降(22% vs.35%,P=0.048),显著降低革兰氏阴性杆菌感染(P=0.003),平均开腹的次数也显著降低(P<0.05)。结果提示,重症急性胰腺炎患者SDD可以明显减少感染性胰腺坏死的发生率,并显著降低死亡率。但该项研究两组患者存在非随机全身应用抗生素治疗的情形,因此,对该研究结果的解读较谨慎。IAP/APA指南推荐急性胰腺炎患者行SDD对于预防感染性并发症显示了一些益处(2B级,低度共识),需进一步的研究。
3.早期肠内营养(EN)预防坏死感染的作用2006年,HidehiroSawa等将90例SAP患者随机分成3组,A组:SDD(−)EN(−),B组:SDD(+)EN(−),和C组: SDD(+)EN(+),结果显示SDD降低器官功能障碍的发生率(从70%到59%)和死亡率(从40%到28%),但没有统计学差异,而添加肠内营养后降低胰腺坏死感染的发生率(从31%到24%)和胰腺手术率(从28%到18%),更进一步降低了死亡率(从单独用SDD的28%降低到16%),但也没有统计学上的显著差异。但研究结果提示SDD和EN有可能降低重症急性胰腺炎患者的并发症和死亡率。
随后多个RCT研究证实,早期肠内营养显著降低胰腺坏死感染的发生率,因此,两个指南一致推荐。
4.肠道益生菌的作用一项针对预计发生重症急性胰腺炎患者的RCT研究中,特别联用肠道益生菌株(如:Ecologic 641)未能预防感染性并发症,反而增加了死亡率。因此,IAP/APA指南不推荐针对急性胰腺炎患者预防性应用肠道益生菌以防止感染性并发症(1B级,高度共识)。由于肠道益生菌的类型和剂量等不同,肠道益生菌的作用尚需要进一步研究证实。
六、急性胰腺炎营养支持模式的改变
SAP患者机体处于高代谢、高分解代谢及明显的负氮平衡,病情重,死亡率高,营养支持治疗势在必行,可以为机体提供必需的营养物质,维护肠黏膜屏障,减少并发症的发生。近年来随着对胃肠功能认识的加深和营养支持治疗技术的进步,SAP的营养支持治疗模式发生了显著变化,并对SAP的治疗模式和预后产生了重要影响。ASPEN 、ESPEN及多个胰腺炎相关学术机构等先后就SAP的营养治疗发布指南。SAP营养支持模式的变迁——SAP的营养支持实践,大致分为3个阶段:全胃肠外营养(total parenteral nutrition, TPN)模式、阶段性营养支持模式和早期肠内营养模式。
第一阶段:20世纪70年代~20世纪90年代初期,为TPN模式。20世纪60年代末产生的TPN技术在SAP中的应用具有重要的意义:①为长期禁食的患者提供营养支持治疗;②不增加胰腺的外分泌;③为延期手术创造了条件。在此后的相当长时间内,SAP的营养支持是以TPN为主的。这一时期文献报道TPN的应用改善了SAP的预后,显著降低了其病死率。
第二阶段:20世纪90年代初期~21世纪初期,为阶段性营养支持模式。即根据SAP病程的不同阶段实施营养支持:在SAP的急性反应期以TPN为主,以肠内营养为辅,并从TPN逐渐过渡到肠内营养;在SAP的感染期以肠内营养为主,提供适当的营养底物;在SAP的残余感染期,营养支持方式为肠内营养,最终过渡到经口饮食。
第三阶段:21世纪至今,为早期肠内营养模式。随着对SAP肠黏膜屏障功能认识的加深,营养支持的功能不再被单纯认为是“营养”,而是寄希望于更早使用肠内营养能改善肠黏膜屏障功能,调节过度的炎性反应和肠源性感染。进入21世纪,在SAP的治疗实践中开始了早期肠内营养模式。即在SAP的急性期内,血流动力学和内稳态稳定后,立即建立空肠营养通道,开始肠内营养,只有当肠内营养不能实施时,才考虑用肠外营养。
2013 ACG指南推荐:
1)对于轻型急性胰腺炎患者,如果没有恶心呕吐,腹痛已经缓解,可立即开始经口喂养(有条件的推荐,中等级别的证据质量)。
2)对于轻型急性胰腺炎患者,初始经口进低脂固体饮食看起来和无渣液体饮食一样安全(有条件的推荐,中等级别的证据质量)。
3)对于重症急性胰腺炎患者,推荐行肠内营养来预防感染并发症的发生。避免使用肠外营养,除非肠内营养途径无法建立、肠内营养不能耐受或者单纯的肠内营养无法满足患者的能量需求(强烈推荐,高级别的证据质量)。
4)经鼻胃管喂养和经鼻肠管喂养在安全性和有效性方面看起来相当(强烈推荐,中等级别的证据质量)。
2013 IAP/APA指南推荐:
1)轻型胰腺炎患者当腹痛减轻、炎症指标在改善,即可恢复经口饮食(2B级,高度共识)。有RCT研究表明,不必等到腹痛完全消失及实验室指标完全正常后,再恢复经口饮食,经口饮食可以直接从固态饮食开始,不必从流质和半流质饮食起步。
2)肠内营养管鼻饲的指征:肠内营养管鼻饲对于拟诊重症急性胰腺炎需营养支持的患者是一项主要治疗手段(1B级,高度共识)。有2篇Meta分析证实,肠内营养较之肠外营养能够减少全身感染、多器官功能衰竭、外科操作及死亡率,绝大多数研究针对的是拟诊重症急性胰腺炎患者。最近一项涵盖60名重症急性胰腺炎患者的RCT研究显示,入院48小时内开始肠内营养较之7天后开始肠内营养能够改善预后。
3)肠内营养制剂类型选择:要素制剂及多聚体制剂均可用于急性胰腺炎的肠内营养(GRADE 2B,高度共识)。
4)肠内营养途径:经鼻空肠管还是鼻胃管?
鼻空肠管及鼻胃管途经均可用于急性胰腺炎的肠内营养(2A级,高度共识)。有2项相关的小型RCT研究提示,经鼻胃管途径鼻饲是可行及安全的。尽管经鼻胃管操作可能较之经鼻空肠管容易,但有部分患者由于胃排空延迟而不能耐受鼻饲。
5)肠外营养的作用:当急性胰腺炎患者需要营养支持而鼻空肠营养不能耐受的情况下,肠外营养可以作为二线治疗(2C级,高度共识)。当经口饮食或肠内营养不能满足要求时,才可开始肠外营养。肠外营养的启动建议延迟至少5天以上,为恢复经口饮食或肠内营养提供机会。
从最新的两个指南中可以看出SAP营养治疗的几大趋势:①肠内营养的作用和地位越来越重要,肠外营养成为二线治疗。②过去以“控制胰酶为重心”的模式,越来越明显被“以肠源性感染预防治疗为中心”的模式所取代,早期肠内营养是近年最大的实践进展。同时,我们也注意到,尽管有RCT研究结果支持SAP时经胃肠内营养的可行性,但是,在临床实践中较重的病例胃排空障碍显著,耐受性显著下降,实施经胃肠内营养有许多困难,尚待进一步RCT研究证实。
七、重症胰腺炎外科治疗的历史演变和当前的观点
重症急性胰腺炎的认识和实践在过去100多年间是在争议中前进和发展的。
1.初期的“保守治疗”到“手术治疗”Fitz在1889年曾经系统地描述了SAP ,并认为:“在该病的早期进行手术十分有害”。但随后经过14年的临床实践,他推翻了过去的观点,并认为:“正像大多数腹部手术能缓解急性症状一样,早期手术治疗对SAP患者更有益”, 这一观点当时得到普遍的认同。1925年,Moynihan正式提出了小网膜囊内清创和腹腔引流等经典手术方式。
2.“手术治疗”到“保守治疗”然而,随着不断的临床实践,人们发现早期手术的效果并不理想,病死率并没有因积极的早期手术而下降,甚至反而升高。在1938年德国外科大会上,以Nordmann的总结报告为代表,SAP的治疗开始走向了全面保守治疗。在随后30年间,发现许多患者死于休克、腹膜炎和器官功能衰竭,人们开始意识到保守治疗并不能解决SAP的问题,认识到“坏死组织溶解吸收是造成休克、肺和其他器官致命性损害的重要原因,清除坏死组织是治疗休克的一个重要组成部分”。
3.“保守治疗”到“积极的手术治疗”随后在20世纪60~80年代,外科手术在SAP中的作用得到重新确立,手术治疗变得积极,手术的方式也由单纯的清创引流发展到了胰腺大部分切除,甚至全胰切除,这一阶段的病死率由以往的80%~90%降至40%~50%。
4.“积极的手术治疗”到“器官功能维护为主的综合治疗”20世纪90年代,随着重症的发展和进步,使休克和早期器官功能障碍不再是SAP死亡的主要原因,胰腺和胰周的感染成为死亡的主要原因,从预防和治疗胰腺坏死感染的角度去重新审视胰腺炎的治疗,使SAP的治疗观念又一次重大转变:在SAP的早期,采取以器官功能维护为中心的非手术治疗,即:无菌性坏死尽量行非手术治疗,坏死感染后采用外科治疗。国内外都基于这一治疗观念制定了新的指南,明确规定了手术适应证和手术时机,总体病死率也下降到了20%~30%。这一时期最有代表性的指南是(2002年IAP指南)。
2002 年IAP指南针对外科处理的11条推荐:
1)轻型胰腺炎不是外科治疗的指征(B级) 。
2)对CT证实的坏死性胰腺炎应用预防性抗生素能降低感染率,但不一定提高生存率(A级)。
3)对有感染表现的患者作细针穿刺加细菌学检验,区分无菌性和感染性坏死 (B级)。
4)有感染症状及体征的感染性胰腺坏死是手术治疗及放射介入引流的指征 (B级)。
5)无菌性胰腺坏死(细菌穿刺抽吸活检结果阴性) 的患者应采用保守疗法,仅对一些特殊病例行手术治疗 (B级)。
6)除非有特定指征,在发病后14 天内对坏死性胰腺炎患者不推荐施行早期手术 (B级)。
7)手术或其他干预手段应尽量有利于脏器的保护,包括坏死组织的清除与术后持续腹膜后引流相结合,充分清除坏死组织和渗液 (B级)。
8)为预防胆源性胰腺炎复发应行胆囊切除术 (B级)。
9)轻型胆源性胰腺炎患者一旦恢复就应立即行胆囊切除术,而且最好在同一次住院期间手术 (B级)。
10)重型胰腺炎应在炎症控制良好、患者恢复后再行胆囊切除术 (B级)。
11)对不宜手术切除胆囊的胆源性胰腺炎患者可以行内镜下十二指肠乳头肌切开术预防复发,但理论上有导致坏死组织感染的危险。
在此背景下,SAP非手术治疗显著增加,开腹手术显著减少,过去通常在开腹手术中实行的附加手术(如:空肠造口、胃造口),在临床实践中要求由介入手段来完成,微创治疗的需求也显著增加。
与此同时,“损伤控制外科(damage control surgery)”理念——以最小的手术创伤达到手术目的——已被广泛接受,SAP的手术方式也发生了深刻的变化,目前已经摒弃了胰腺大部分切除、胰腺次全切除以及胰腺全切除术等巨大手术创伤的方式,除了少数情况需要行腹腔蝶形开放引流手术外,当前推荐的主流手术方式是胰腺坏死组织清除结合手术后胰周引流。由于SAP患者常常病情危重,开腹手术创伤大,往往加重患者术后器官功能损害,手术并发症的发生率和病死率相当高。因此,SAP手术的微创化成为强烈的需求和必然的趋势,近年来影像技术的发展使SAP的微创治疗成为可能,微创治疗也就应运而生了。
5.当前的趋势由单纯的外科治疗感染胰腺坏死组织向以微创为主的综合治疗模式的转变。开腹手术清除引流感染胰腺坏死组织的病死率仍高达11%~39%,因此尽量延迟或避免开腹手术引流感染胰腺坏死组织已成为近年来寻求的新突破,而目前认为微创引流技术是实现这一突破的重要途径。目前针对感染胰腺坏死组织的微创引流技术主要包括: 经皮置管引流(percutaneous catheter drainage, PCD),内镜辅助下后腹膜清创术(video-assisted retroperitoneal debridement, VARD),经胃内镜引流(transgastric endoscopic drainage, TED)。随着时间的推移,采用微创手术的患者逐渐增多,开腹手术患者越来越少。微创治疗与传统的开腹手术比较,手术创伤应激小,术后并发症少,尤其对于病情危重、血流动力学不稳定、多器官功能衰竭、或凝血功能障碍的患者,具有更为重要的意义。
2013 ACG指南推荐:
1)对于轻型急性胰腺炎患者,一旦发现有胆囊结石,出院之前应行胆囊切除术,防止急性胰腺炎的复发。(中等强度推荐,中等级别的证据质量)
2)对于坏死性的胆源性胰腺炎患者,为了防止感染发生,胆囊切除术应该推迟到活动性的炎症消退以及液体积聚吸收或者稳定以后。(强烈推荐,中等级别的证据质量)
3)无症状性的假性囊肿、胰腺和(或)胰外坏死不主张进行干预,不论它的大小、位置和(或)有没有扩大。(中等强度推荐,高级别的证据质量)
4)对于稳定的坏死组织感染患者,外科引流、放射学引导的引流和(或)内镜引流尽可能延迟至4周以后,允许坏死组织内容物液化,周围形成纤维包裹。(强烈推荐,低级别的证据质量)
5)对于有症状的坏死组织感染患者,微创的方法行坏死组织清除较开腹清除更好。(强烈推荐,低级别的证据质量)
2013 IAP/APA指南推荐:
1.坏死性胰腺炎外科操作的指征
(1)坏死性胰腺炎行外科操作(包括放射介入、内镜及外科手术)的一般指征是:①临床怀疑或证实为感染性坏死性胰腺炎,伴临床病情恶化,尤其当坏死灶已形成包裹;②缺乏感染性坏死的证据,但急性胰腺炎发病后器官功能衰竭持续数周,尤其当坏死灶已形成包裹。外科操作少见指征是:①腹腔室隔综合征;②急性持续性出血;③小肠缺血;④大的包裹性坏死灶导致持续的胃肠道或胆道梗阻(一般在胰腺炎发病4~8周后)。(1C级,高度共识)
(2)不建议对胰周积液常规行经皮细针穿刺细菌学检查,因为对大多数患者而言,临床征象(如:持续发热、炎症反应标志物增高)和影像学征象(如:胰周出现气液平面)能够准确诊断感染性坏死。尽管细针穿刺能够证实感染,但结果存在假阴性的风险。(1C级,高度共识)
(3)无菌性坏死性胰腺炎行外科操作(包括放射介入、内镜及外科手术)的指征是:①包裹性坏死灶导致胃肠道或胆道持续梗阻(一般在急性胰腺炎发病4~8周以后);②无感染征象的包裹性坏死灶引起持续症状(如:疼痛、长期不适)(一般在急性胰腺炎发病8周以后);③胰管中断综合征(如:胰腺坏死致胰管完全中断)伴持续性有症状(如:疼痛、梗阻)的液体积聚,伴坏死灶但无感染征象(一般在急性胰腺炎发病8周以后)。(2C级,高度共识)
2.坏死性胰腺炎行外科操作的时机
(1)对于怀疑或证实有感染性坏死的胰腺炎患者,侵袭性操作(包括经皮穿刺置管引流、内镜下经胃穿刺置管引流或坏死组织清除、微创或开放式坏死组织清除术)应当尽量延迟到发病至少4周以后,以利于积液形成包裹。(1C级,高度共识)
(2)最佳可行证据提示,对所有伴坏死性并发症的急性胰腺炎患者而言,外科坏死组织清除术最好应当延迟至积液形成包裹,通常在胰腺炎发病4周以后。没有证据提示患者将从早期外科操作或晚期外科操作分组中获益。(1C级,高度共识)
3.坏死性胰腺炎外科操作方法
(1)对于怀疑或证实有感染性坏死的胰腺炎患者,最佳外科操作方法是首先行影像学引导下经皮腹腔/腹膜后穿刺置管引流或内镜下经胃穿刺置管引流,如有需要,则接着行内镜下或外科坏死组织清除术。(1A级,高度共识)
(2)经皮或经胃穿刺置管引流对于怀疑或证实有(包裹性)感染性坏死的胰腺炎患者应作为首选治疗方法。(1A级,高度共识)
(3)没有充分证据显示针对可疑或证实感染的坏死性胰腺炎患者按照不同治疗方法分组能为患者带来益处。(2C级,高度共识)
新的指南反映了这个新的趋势:优先使用微创引流。但是还出现一系列新的问题,比如:各种介入手段的适应证和时机,各种介入手段之间如何组合达到最优结果,特别是微创介入切换到开腹手术的指征等,亟待进一步的临床研究。
参考文献
1. Yadav D, Lowenfels AB. The epidemiology of pancreatitis and pancreaticcancer. Gastroenterology,2013, 144:1252-1261.
2. Peery AF, Dellon ES, Lund J, et al. Burden of gastrointestinal disease in the United States: 2012 update. Gastroenterology, 2012, 143(5):1179-1187.e1-3.
3. Appelros S, Lindgren S, Borgstrom A. Short and long term outcome of severe acute pancreatitis. Eur J Surg, 2001,167(4): 281-286.
4. Gülzow M, Schoenenmann J, Zastrow R, et al. Guidelines for the diagnosis of acute pancreatitis.ZArztlFortbild (Jena),1971, 65(23):1239-1240.
5. Güzlow M, Zastrow R, Diwok K. Guidelines for the therapy of acute pancreatitis.ZArztlFortbild (Jena), 1971, 65(23):1240-1241.
6. Bradley EL 3rd.A clinically based classification system for acute pancreatitis. Summary of the International Symposium on Acute Pancreatitis, Atlanta, Ga, September 11 through 13, 1992.Arch Surg, 1993, 128(5):586-590.
7. Peter A Banks, Thomas L Bollen, Christos Dervenis, et al. Classification of acute pancreatitis—2012: revision of the Atlanta classification and definitionsby international consensus. Gut, 2013, 62:102–111.
8. Tenner S, Baillie J, DeWitt J, et al. American College of Gastroenterology. American College of Gastroenterology guideline: management of acute pancreatitis.Am J Gastroenterol, 2013, 108(9):1400-1415; 1416.
9. Besselink M, van Santvoort H, Freeman M, et al. IAP/APA evidence-based guidelines for the management of acute pancreatitis.Pancreatology, 2013, 13(4 Suppl 2):e1-15.
10. Buter A, Imrie CW, Carter CR, et al. Dynamic nature of early organ dysfunction determines outcome in acute pancreatitis. Br J Surg, 2002, 89: 298-302.
11. Guidelines for intensive care unit admission, discharge, and triage. Task Force of the American College of Critical Care Medicine, Society of Critical Care Medicine. Crit Care Med, 1999, 27(3):633-638.
12. Gardner TB, Vege SS, Pearson RK, et al. Fluid resuscitation in acute pancreatitis. ClinGastroenterolHepatol, 2008, 6(10):1070-1076.
13. Du XJ, Hu WM, Xia Q,et al. Hydroxyethyl starch resuscitation reduces the risk of intra-abdominal hypertension in severe acute pancreatitis. Pancreas, 2011, 40 (8):1220-1225.
14. Perner A, Haase N, Guttormsen AB, et al. Hydroxyethyl starch 130/0.42 versus Ringer's acetate in severe sepsis. N Engl J Med, 2012, 367(2):124-134.
15. Wu BU, Hwang JQ, Gardner TH, et al. Lactated Ringer's solution reduces systemic inflammation compared with saline in patients with acute pancreatitis.ClinGastroenterolHepatol, 2011, 9(8):710-717.
16. Yunos NM, Bellomo R, Hegarty C, et al. Association between a chloride-liberal vs chloride-restrictive intravenous fluid administration strategy and kidney injury in critically ill adults. JAMA, 2012, 308(15):1566-1572.
17. Mao EQ, Tang YQ, Fei J, et al.Fluid therapy for severe acute pancreatitis in acute response stage.Chin Med J (Engl),2009, 122(2):169-73.
18. Mao EQ, Fei J, Peng YB. Rapid hemodilution is associated with increased sepsis and mortality among patients with severe acute pancreatitis. Chin Med J (Engl), 2010, 123(13):1639-1644.
19. Mole DJ, Hall A, McKeown D, etal.Detailed fluid resuscitation profiles in patients with severe acute pancreatitis.HPB (Oxford). 2011; 13(1):51-58.
20. Kirkpatrick AW, Roberts DJ, De Waele J, etal.Intra-abdominal hypertension and the abdominal compartment syndrome: updated consensus definitions and clinical practice guidelines from the World Society of the Abdominal Compartment Syndrome. Intensive Care Med, 2013, 39(7):1190-1206.
21. De Waele JJ, Leppaniemi AK. Intra-abdominal hypertension in acute pancreatitis. World J Surg, 2009, 33:1128-1133.
22. Al-Bahrani AZ, Darwish A, Hamza N, et al. Gut barrier dysfunction in critically ill surgical patients with abdominal compartment syndrome. Pancreas, 2010, 39: 1064-1069.
23. Mentula P, Hienonen P, Kemppainen E, et al. Surgical decompression for abdominal compartment syndrome in severe acute pancreatitis. Arch Surg, 2010, 145:764-769.
24. Kramer KM, Levy H. Prophylactic antibiotics for severe acute pancreatitis: the beginning of an era. Pharmacotherapy,1999, 19(5):592-602.
25. Dellinger EP, Tellado JM, Soto NE, etal.Early antibiotic treatment for severe acute necrotizing pancreatitis: a randomized, double-blind, placebo-controlled study. Ann Surg, 2007, 245(5):674-683.
26. Luiten EJ, Hop WC, Lange JF, et al. Controlled clinical trial of selective decontamination for the treatment of severe acute pancreatitis. Ann Surg, 1995, 222(1):57-65.
27. Sawa H, Ueda T, Takeyama Y, et al. Treatment outcome of selective digestive decontamination and enteral nutrition in patients with severe acute pancreatitis. J HepatobiliaryPancreatSurg, 2007, 14(5):503-508.
28. Besselink MG, Van Santvoort HC, BuskensE,et al. Probiotic prophylaxis in predicted severe acute pancreatitis: a randomised, double-blind, placebo-controlled trial. Lancet, 2008, 371:651-659.
29. 李维勤.重症急性胰腺炎患者营养模式的变迁.肝胆外科杂志,2009,17(5):328-329.
30. Singh N, Sharma B, Sharma M, et al. Evaluation of early enteral feeding through nasogastric and nasojejunal tube in severe acute pancreatitis: a noninferiority randomized controlled trial. Pancreas, 2012 Jan, 41(1):153-159.
31. 李维勤.重症急性胰腺炎手术治疗的共识与争论.肝胆外科杂志,2008,16(4):241-243.
32. vanSantvoort HC, Besselink MG, Bakker OJ, et al. A step-up approach or open necrosectomy for necrotizing pancreatitis. N Engl J Med, 2010,362(16):1491-1502.
33. Babu RY, Gupta R, Kang M, et al. Predictors of surgery in patients with severe acute pancreatitis managed by the step-up approach. Ann Surg, 2013, 257(4):737-750.
34. Rodriguez JR, Razo AO, Targarona J, et al. Debridement and closed packing for sterile or infected necrotizing pancreatitis: insights into indications and outcomes in 167 patients. Ann Surg,2008, 247:294-299.

李维勤,南京军区南京总医院普通外科主任医师,南京大学医学院教授、博士研究生导师,“长江学者”特聘教授,军队学科拔尖人才。现任中国医师协会胰腺病分会副主任委员,全军普通外科专业委员会胰腺外科学组副组长,中华医学会外科学分会胰腺外科学组委员,江苏省医学会胰腺病分会副主任委员,全军重症医学专业委员会副主任委员,中华医学会重症医学分会常务委员,中国医师协会重症医学分会常务委员,江苏省医学会重症医学分会副主任委员,南京医学会重症医学分会主任委员。
来源:人民卫生出版社《临床知识》约稿
作者:李维勤,南京军区南京总医院普通外科主任医师、教授;童智慧
编辑:环球医学资讯贾朝娟
- 评价此内容
- 我要打分
近期推荐
热门关键词
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号


 会员登录
会员登录

