原以为是间质性肺病 CT及支气管肺泡灌洗发现并非如此…
56岁女患者以间质性肺疾病入院。当地医院胸片示双肺多发斑片影,考虑肺炎,给予多种抗生素治疗却无效,后来又怀疑为间质性肺炎,遂服用泼尼松,治疗效果仍然不佳。经胸部高分辨率CT结果以及支气管肺泡灌洗标本检查结果,最终才明确诊断,该患者可能患有……
患者女,56岁,以间质性肺疾病入院。当地医院胸片示双肺多发斑片影,考虑肺炎,给予多种抗生素治疗无效,后怀疑间质性肺炎而服用泼尼松,治疗效果不佳。既往史:工作中接触铅粉2年。查体:双下肺可闻及少许爆裂音,杵状指趾(-)。胸部高分辨率CT(HRCT)双肺野透光度减低,可见散在弥漫的毛玻璃密度影,局部地图样改变;部分病灶融合成片,有支气管充气征,部分病灶呈网状蜂窝状,双侧弥漫性小叶间隔增厚,怀疑过敏性肺泡炎或肺泡蛋白沉积症,支气管肺泡灌洗(bronchoalveolar lavage,BAL)涂片过碘酸雪夫染色(PAS染色)阳性,经多次纤支镜分段支气管肺泡灌洗后,症状明显改善,出院后定期随诊(图1)。
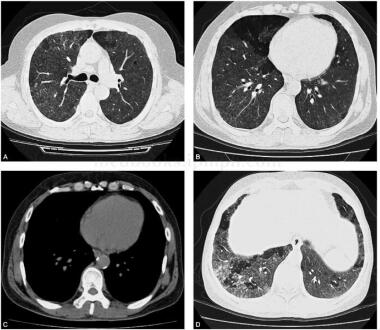
图1 肺窗内两肺见弥漫分布的斑片状毛玻璃密度影,延伸至胸膜下;肺窗内双肺内毛玻璃密度影局部呈地图样分布,分界清楚;相同层面的纵隔窗,未见明显异常,毛玻璃密度影未见显示;右肺下叶病灶内见斑片样高密度影,密度稍高于毛玻璃密度
【诊断】
肺泡蛋白沉积症
一、概述
肺泡蛋白沉积症(pulmonary alveolar proteinosis,PAP)又称Rosen-Castle-man-Liebow综合征,是一种以肺泡及终末呼吸性细支气管内富含磷脂蛋白样物质沉积为特征的少见疾病,其病因未明,可能与免疫功能障碍有关。临床以反复咳嗽和进行性呼吸困难发病,双肺呈弥漫性改变,肺泡及细支气管内充填有富磷脂蛋白质物质,过碘酸雪夫(PAS)染色阳性。
【病因】
本病好发于青中年,可发生于任何年龄,以30~50岁男性多见,男性发病约3倍于女性。约半数病例有家族遗传倾向。PAP可分为原发及继发型,病因不明的称原发性;继发性分为三种类型:①继发于恶性肿瘤及其他导致患者免疫功能严重低下的疾病,最常见于血液系统恶性肿瘤,肺癌也可合并PAP;②肺部感染;③吸入某些无机矿物质或化学物质。PAP的病因及发病机制尚不明确,目前有多种假说:①肺泡巨噬细胞功能异常,使肺泡表面活性物质利用障碍;②肺泡表面活性物质生成过多或清除减少;③吸入硅、铝等无机粉尘;④结核分枝杆菌、诺卡菌、真菌和卡氏肺孢子虫等感染;⑤免疫缺陷状态等;由于机体内、外因素作用引起肺泡Ⅱ型细胞增生,分泌功能增强,肺泡巨噬细胞活性缺乏,清除功能异常。
【病理】
肺活检(经支气管肺活检TBLB和开胸肺活检)是诊断PAP的金标准。但是它并不是必需的诊断步骤,而且也存在采样误差导致的假阴性结果,由于PAP病灶呈斑片状,TBLB的敏感性较低,诊断价值有限。开胸肺活检并发症较多,危险性较高,难以常规开展。
诊断性BAL是一个非常安全简便实用有效的诊断方法。在约75%的可疑病例中,支气管肺泡灌洗(bronchoalveolar lavage,BAL)标本的检查结果能够明确诊断。PAP病人的灌洗液(BALF)外观呈现为混浊乳白色液体,它含有大量类单核细胞的肺泡巨噬细胞及淋巴细胞,其他类型的炎症细胞则相对较少。同时存在大量PAS染色阳性的非细胞性、嗜酸性颗粒状物质以及表面活性蛋白水平升高,蛋白定性试验(++),PAS染色(+~++)。
大体病理显示肺大部分呈实变,胸膜下可见黄色或黄灰色结节,切面有黄色液体渗出。活检组织光镜所见肺实质结构保持完好,除非合并感染。肺泡及细支气管内有嗜酸PAS强阳性物质充塞,是Ⅱ型肺泡细胞产生的表面活性物质磷脂与肺泡内液体中的其他蛋白质和免疫球蛋白的结合物,未被破坏和正在退化中的巨噬细胞显示清楚,肺泡隔及周围结构基本完好,电镜可见肺泡巨噬细胞大量增加,吞噬肺表面活性物质,胞浆肿胀,呈空泡或泡沫样外观。免疫组化染色提示大量表面活性蛋白积聚,肺泡内脂含量高,可能是因为肺泡磷脂的清除异常。间质纤维化少见。病理过程可能为弥漫性或局限性,可能进展亦可能稳定,或自行消失。胸膜和纵隔不受影响。
【流行病学特征】
临床上以隐袭性起病,约1/3患者无症状,典型症状为活动后气促,以后进展至休息时亦感气促,干咳或咳白色、黄色痰,还可表现为低热、胸痛、体重下降,全身症状亦可不明显,偶继发感染而出现相应症状。早期较轻病例可无明显临床症状,仅影像学检查有异常表现,易误诊为肺炎,经抗炎治疗症状可缓解,但肺部阴影反而进展,应考虑本病可能。
二、影像学表现
(一)普通X线检查
CXR是诊断PAP的一项基本检查,CXR的表现多种多样,阴影可出现在临床症状之前。最常见的阴影为以肺腺泡为基本单位的肺实变阴影,即主要显示肺泡性浸润。从两中下肺开始,沿肺纹理有粗糙的结节状阴影,大小不一,随疾病的发展可相互融合。肺泡性浸润主要表现为两肺广泛的结节、斑片,大片实变影,部分斑片影与周围正常肺实质的分界锐利,形成地图样改变;其间质异常主要表现为线状、网状影及小叶间隔增厚影,小叶间隔增厚常出现于毛玻璃样改变区,形成碎石路样表现。
(二)CT表现
胸部CT既能显示肺部浸润又能显示间质异常,在评价病灶分布范围、病变类型(腺泡型或间质型)方面比胸片优越。特别是HRCT的应用,对于PAP有了更深刻更全面的认识,可评价疾病的严重程度和对治疗的反应。在HRCT检查出现之前,PAP患者从出现症状到确诊的平均时间是2年,但HRCT检查出现之后,该时间缩短至8~12个月。HRCT能准确观察病变的形态和分布,典型的表现(如地图样表现、碎石路样表现)与病理改变一致,具有一定的特征性,是临床诊断的有用方法。
1.毛玻璃密度影
当病变仅累及肺泡腔时,低密度的磷脂蛋白样物质充填肺泡,肺泡发生不同程度的实变,影像学上表现为肺部形态各异的斑片状毛玻璃密度影,增强扫描病灶未见强化,反映病灶是乏血供的,无肉芽组织形成。
2.地图样改变
PAP病变多为对称或不对称两肺分布,肺野中央及外周均可发生。斑片状毛玻璃密度影与正常的肺组织分界清楚,正常与异常的肺组织截然分开,在肺野中呈地图样改变。全肺灌洗治疗后,毛玻璃影变淡,似棉絮样簇积排列,边界更清晰,病灶地图样分布的特征更明显。其形成机制可能与病变分布以肺小叶为单位,小叶间隔在一定程度上限制了病变的蔓延,以及病变周围相对正常的肺组织存在一定程度代偿性肺气肿有关。
3.铺路石样改变
当病变累及小叶间隔时,小叶间隔因水肿或细胞浸润而增厚,表现为散在或弥漫分布的毛玻璃影及其内部增粗增厚的小叶间隔形成网格状的铺路石样改变。病理基础是肺泡尚有部分充气,充填的磷脂蛋白样物质密度低于间隔软组织。增强扫描清楚显示,沿肺纹理走行的增粗、迂曲的小叶间隔强化,与病理学上间质水肿、小血管扩张充血一致,而非纤维组织增生。
4.肺实变样表现
在疾病晚期,大量蛋白样物质沉积在肺泡,导致肺脏体积缩小。两肺透亮度降低,密度增高,以两下肺野为主。实变内可见结节影或片状模糊影,支气管充气征阳性。
PAP的影像学表现呈现多样化且非特异性的特点。早期表现为范围较小的斑片状阴影(地图样表现),肺脏体积正常;如果病情进展,斑片状阴影逐渐增大融合,集中在肺野中央自肺门向外放射(肺水肿样表现),或形成以两种、下肺野外围为主的粗大网状影,肺野呈毛玻璃样改变(间质纤维化样表现),肺脏体积逐渐减小;晚期则出现两肺透过度降低,密度增高,支气管充气征明显,肺脏体积明显缩小(肺实变样表现),近胸膜处病变少见。经全肺灌洗后,肺部阴影明显减少,但仍遗留不同范围的弥漫性小片状阴影。伴随灌洗的反复进行和时间的延长,肺部阴影可逐渐消退。在1~3个月(平均6周)后,PAP的影像学表现的改善最为明显。
PAP的影像学表现和临床表现的严重程度经常不成比例,即影像学和体征分离。但影像学改变范围和严重程度与肺功能或血气分析所反映的肺部受损程度密切相关。当病变<全肺1/4时,影像学常表现为地图样或碎石路样改变,常无临床表现,动脉血气分析和肺功能检查可能正常。本病进展缓慢,即使临床过程进行性恶化的PAP,影像学表现出现大片状阴影(如肺水肿或间质纤维化),如果不合并肺部感染,患者除了咳嗽、胸闷外,日常生活仍可以基本维持,但是活动时呼吸困难加重,一旦进入大面积肺实变期,则出现明显的临床症状,平静状态下即可出现呼吸困难。临床和影像学的发现经常提示PAP的诊断,尤其是出现典型的临床表现(症状:进行性加重的活动性呼吸困难和咳嗽;体征:吸气性爆裂音或裂帛音、发绀、杵状指等),典型的影像学表现(地图样表现、碎石路样表现等),且肺部阴影相对稳定(即短期内如无肺部感染,则肺部阴影不会发生显著变化)。若临床表现和影像学表现不平衡(即缺乏和影像学表现严重性相对应的临床症状),高度提示本病的诊断。
因本病罕见,症状、体征分离,影像学表现和临床表现的严重程度不一致,影像学表现多样化且非特异性的特点,故极易导致临床误诊,临床上,PAP需与肺炎(支气管肺炎、真菌性肺炎、肺孢子虫肺炎)、肺结核、肺泡细胞癌、特发性肺间质纤维化、急性嗜酸性肺炎/过敏性肺泡炎、尘肺、结节病、肺含铁血黄素沉着症、肺泡微石症等鉴别。
1.肺炎
容易并发肺部感染是此病的一个重要特征。PAP早期临床表现并不明显,且影像学改变(如两肺可见弥漫性斑片状阴影)多于健康体检或感冒后行胸部X线检查时发现,随病情进展,部分患者易反复感染肺炎,出现呼吸道感染的症状和体征,两者容易混淆,此时极易误诊为肺炎。鉴别要点包括:
(1)PAP的肺部阴影改变相对稳定,演变缓慢;肺炎的阴影可随病情的变化而迅速改变。
(2)PAP的临床表现和影像学表现不平衡;肺炎的临床严重程度通常和影像学表现相关,同时还伴随其他感染综合征(如发热、咳痰、血象异常等)。
(3)PAP的肺部阴影呈两侧多叶性分布,典型者为地图样表现或碎石路样表现,病变与周围组织分界清楚;而肺炎典型者多呈肺叶或肺段分布,为片状云絮状,边界欠清。
(4)PAP的肺部阴影经有效的治疗性肺泡灌洗,抗生素治疗无效;肺炎的阴影则在有效抗生素治疗的前提下,可以伴随症状缓解而逐渐消失。
2.特发性肺间质纤维化(idiopathic pulmonary fibrosis,IPF)
PAP可有间质纤维化样表现(肺野呈毛玻璃样改变),病理改变也存在少量间隔增厚和纤维化,其临床和影像学表现与一些间质性肺病有重叠,需要考虑两者之间的鉴别诊断。
(1)IPF肺部阴影呈弥漫性,PAP的病变组织和正常组织分界清晰,即CT上的地图样表现。
(2)IPF肺内见粗大网状影,同时有蜂窝状气肿或肺大疱,PAP一般不合并没有蜂窝状气肿或肺大疱。
(3)IPF罕有肺实变,PAP晚期则出现肺实变。
(4)IPF的灌洗液中有较多细胞成分,PAP的灌洗液中则少见细胞结构,PAS染色阳性。
(5)治疗性BAL对IPF无效,肺部阴影无变化,而PAP的肺部阴影经治疗后明显减少。
3.细支气管肺泡癌
鉴别要点如下:
(1)病程:肺泡细胞癌进展迅速,PAP的病程较长,病情演化较慢。
(2)肺泡细胞癌患者常咯大量水样白色痰,PAP常为干咳,咳痰不多,痰的特征一般对诊断帮助不大。
(3)肺泡细胞癌常合并纵隔淋巴结肿大,全身情况较差,恶病质多见,PAP则不合并纵隔淋巴结肿大,全身情况较好,恶病质少见。
(4)弥漫性细支气管肺泡癌可表现为大小不等粟粒结节,或弥漫性肺实变,呈毛玻璃样,但其边缘模糊,病变进展较快,PAP为密度较低且均匀的斑片状阴影。
4.肺泡性肺水肿
肺泡性肺水肿表现为边缘模糊的斑片状阴影,典型者两肺大片影聚集于肺门区周围形成“蝶翼状”阴影,另外肺水肿变化快,经治疗后短期可吸收。临床有心脏病症状和体征,有心脏形态增大,常伴胸腔积液。而PAP无临床心脏病症状和体征,且毛玻璃密度影呈地图样分布。
5.结节病
结节病是一种原因不明的以非干酪性炎性肉芽肿为特征的多系统疾病。最常见的肺部病变为弥漫性网状结节影,大小不一。由于其病理基础是炎性肉芽肿,增强扫描其融合的大结节可见强化。肺部毛玻璃影程度不一,以中上肺野为主,胸膜下小叶间隔增厚。单纯肺部病变的结节病与PAP较难区分,但结节病常常两侧肺门淋巴结对称性肿大,纵隔淋巴结肿大,而PAP肺门及纵隔淋巴结均不大。
6.卡氏肺孢子虫肺炎(pneumocystis carinii pneumonia,PCP)
PCP又称卡氏肺囊虫病,是人类免疫缺陷病毒(HIV)感染病人中的最常见机会性感染,最常见症状是隐袭发生,进行性呼吸困难、干咳和低热。典型X线特征是弥漫性双侧或网状小结节样阴影,而后迅速向两肺野发展,半数以上患者可出现支气管充气征,肺尖和肺底很少累及。两者的临床、影像学表现和部分组织学改变均相似。但PCP多发生在血液病晚期或极度衰竭者,其CXR的表现为阴影不规则,肺周围的病灶融合,出现突然。其肺泡内所含物质亦可PAS染色阳性,但为泡沫状或囊状。PCP的诊断可在细胞学涂片上查见病原体,Gomori银染色可显示肺囊虫的包囊。
(环球医学编辑:余霞霞)
来源:《疑难病例影像诊断评述》
作者:郭启勇 卢再鸣
页码:34-37
出版:人民卫生出版社
- 评价此内容
- 我要打分
近期推荐
热门关键词
合作伙伴
Copyright g-medon.com All Rights Reserved 环球医学资讯 未经授权请勿转载!
网络实名:环球医学:京ICP备08004413号-2
关于我们|
我们的服务|版权及责任声明|联系我们
互联网药品信息服务资格证书(京)-经营性-2017-0027
互联网医疗保健信息服务复核同意书 京卫计网审[2015]第0344号



 会员登录
会员登录

