-
FDA批准sotatercept用于治疗肺动脉高压
环球医学资讯

 1小时条评论
1小时条评论肺动脉高压(PAH)是一种罕见、进行性且危及生命的心血管疾病,预后极差。 近期,美国食品药品管理局(FDA)已批准sotatercept用于治疗PAH(WHO第1组)成人,以提高运动能力,改善WHO功能分级,降低临床恶化事件的风险。 具有突破性治疗资格的sotatercept是一种first...
-
“人造子宫”要来了?FDA开会讨论是否批准人体临床…
环球医学资讯

 1小时条评论
1小时条评论2022 年底,“世界首个人造子宫设施诞生”饱受争议,8分钟的短片引发全球热议。 当地时间9月19日~20日,美国食品和药品监督管理局(FDA)召开独立顾问委员会议,讨论是否应该批准全球首个“人造子宫”技术的人体临床试验。 FDA开会讨论是否批准...
-
癌症孤儿药适应证的美国FDA批准、临床试验证据、有…
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论1983年通过的《孤儿药法案》旨在促进和财政激励影响少于200000美国公民的罕见病的药物研发。2023年5月,德国学者发表在《BMJ》的横断面分析,考察了非孤儿和极罕见、罕见和常见孤儿癌症药物适应证的美国食品药品监督管理局(FDA)批准、临床试验证据、有效性、流行病...
-
近20年来FDA批准的抗癌新药 证据基础如何?
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论近20年来,癌症新疗法层出不穷。那么,FDA批准的抗癌新药,证据基础如何呢?2023年6月,发表在《Int J Cancer》的一篇文章,给出答案。 人们担心,加速批准抗癌药物的监管计划可能增加对生存和生活质量(QoL)获益和危害的不确定性。 研究人员分析了2000年至2020年间...
-
FDA授权限制处方组合药中对乙酰氨基酚含量不超过325…
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论2011年1月,美国食品和药品监督管理局(FDA)宣布强制要求在2014年3月前将对乙酰氨基酚和阿片类药物处方组合中的对乙酰氨基酚限制在325mg /片,并要求制造商遵守规定。这一规定对随后的涉及对乙酰氨基酚和阿片类药物毒性导致的住院和急性肝功能衰竭有何影响呢?2023...
-
美国FDA批准药物的关键试验参与者有多大比例从中低…
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论支持美国食品和药物管理局(FDA)批准药物临床试验中的参与者,多大比例是从低收入和中等收入国家(LMIC)招募?2022年12月,发表在《Ann Intern Med》的一项研究显示,从LMIC中招募的参与者的比例分别为:癌症56%、心血管疾病79%、神经系统疾病56%。 背景:许多支持...
-
2008~2019FAERS中识别出的潜在安全性信号 FDA对大多…
环球医学资讯

 1小时条评论
1小时条评论医学文献检查、“哨点行动”的使用程度及其对潜在安全信号评估的影响尚不清楚。2022年10月,发表在《BMJ》的一项研显示,多数从FDA不良事件报告系统(FAERS)中识别的潜在安全性信号使得FDA采取监管行动。仅有三分之一的监管行动由发表的研究证实,但没有...
-
纤维肌痛:阿米替林vs FDA批准的治疗
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论纤维肌痛是一种常见疾病,其特征是广泛的慢性疼痛、身体疲惫、认知困难、情绪低落、睡眠问题和生活质量(QoL)下降。2022年5月,美国和加拿大学者发表在《JAMA Netw Open》的一项系统评价和网状Meta分析,比较了阿米替林和美国食品和药物管理局(FDA)批准的治疗纤维...
-
再也不用捅嗓子了?FDA紧急授权首个新冠呼吸分析仪 …
环球医学资讯

 1小时条评论
1小时条评论再也不用戳喉咙、捅鼻子了?近日,美国食品药品监督管理局(FDA)紧急授权首个新冠呼吸检测平台,吹口气,3分钟出结果。 FDA紧急授权一种新冠呼吸分析仪 3分钟出结果 这是FDA颁发的首个通过检测呼吸样本中新冠感染相关的化合物来诊断新冠肺炎的紧急使用授权(EUA)。...
-
FDA批准的CAR-T的关键临床研究中 黑人血液恶性肿瘤…
环球医学资讯

 1小时条评论
1小时条评论有效治疗可及性差的黑人群体中,有些血液系统恶性肿瘤更常见。近几年,嵌合抗原受体T细胞(CAR-T)是血液恶性肿瘤治疗领域的重大进展,但是美国食品和药物管理局(FDA)批准的CAR-T产品相关临床研究中,纳入的黑人患者比较少。 2022年4月,美国学者发表在《JAMA Netw...
-
当有效性证据处于边缘时 FDA做出批准决定的理由多样化
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论对于一些治疗严重危及生命或缺乏治疗手段疾病的药物,美国食品和药物管理局(FDA)的审批灵活性很大。2021年11月,发表在《Ann Intern Med》的一项研究,对912个此类申请回顾后发现,审批决定高度异质性,需要一个先例传统和合适的信息系统来改善机构记忆。 背景:对...
-
重磅!FDA紧急授权“双抗体鸡尾酒疗法”同时治疗和…
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论近日,FDA扩大了对“双抗体鸡尾酒疗法”(casirivimab联合imdevimab)的紧急授权范围,允许该疗法用于有高风险进展为严重COVID-19的人群进行暴露后预防性治疗。该疗法是美国目前唯一可同时用于COVID-19治疗和预防的抗体疗法。 “双抗体鸡尾酒疗法&rdq...
-
FDA和EMA加速审批的新药 治疗价值更高?
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论全球临床实践中引入的大多数新药都是由美国食品和药物管理局(FDA)和欧洲药品管理局(EMA)首先批准的。在过去的20年中,针对严重疾病,两个监管机构都制定了加快药物研发和监管审查的项目。2020年10月,美国和瑞士学者发表在《BMJ》的一项回顾性队列研究,考察了FD...
-
美国FDA批准的疫苗 上市后安全吗?
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论2020年9月,以色列学者发表在《Ann Intern Med》的一项队列研究,考察了美国食品和药物管理局(FDA)批准的疫苗的上市后安全性。 背景:疫苗是公共卫生最伟大的成就之一。还未系统研究过审批后新出现的疫苗相关安全问题的流行程度和临床意义。 目的:旨在探讨美国FDA...
-
FDA紧急放行使用血浆治疗新冠肺炎 特朗普的连任筹码?
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论新冠肺炎全球蔓延,美国疫情不容乐观。23日,美国食品药品监督管理局(FDA)宣布,紧急批准以新冠肺炎康复者的血浆作为治疗方法。而在此前一天,美国总统特朗普刚批评FDA内的“黑暗势力”从中作梗,“故意拖延”新冠肺炎患者的治疗和疫苗试验。2...
-
FDA批准居家检测试剂盒 疫情背后彰显科技实力
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论美国疫情的暴发牵动着全球民众敏感的神经,在迅速增加的确诊人数背后是美国接受新冠病毒检测的人数也在暴涨。最初在2月29日时,全美的共检测人数仅为472人,而截至4月末,检测数据已上升至每日数百万级,甚至还需要达到每日检测数千万的人群!美国如何做到?疫情背后...
-
用还是不用?防晒霜6个检测活性成分均会被人体吸收 …
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论防晒霜是很多人都会使用的护肤品之一。2020年1月,发表在《JAMA》的一项随机临床试验,在健康参与者中评估了4种防晒霜的6种活性成分的血药浓度。结果表明,以4种不同防晒霜配方中的所有6种测试活性成分均被人体系统地吸收了,并且血药浓度超过了FDA阈值。然而,这些...
-
FDA批准抗癌药的关键临床试验:心血管事件报告率准…
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论心血管疾病(CVD)已成为有效抗癌治疗的瓶颈。但在批准抗癌药物上市的关键临床试验中,CVD的报告情况如何?2020年2月,美国学者在《J Am Coll Cardiol》发表的研究,结果表明,这些关键临床试验报道的CVD事件率低于同期总体人群发生率,应引起警觉。 背景:CVD越来越...
-
一文了解FDA未批准的改变病情类药物治疗神经退行性…
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论2020年1月,加拿大学者发表在《Neurology》的一项系统评价和Meta分析,考察了未获批的改变病情类药物治疗神经退行性疾病的风险和获益。 目的:旨在通过对随机安慰剂对照试验(评估阿尔兹海默病、帕金森病、亨廷顿病、肌萎缩侧索硬化(ALS)的研究性治疗)的系统评价...
-
FDA不良事件报告中AKI较高 需要研究来确定潜在的肾…
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论2018年8月,发表于《Pharmacotherapy》上的一项研究,考察了美国食品药品监督管理局(FDA)不良事件报告系统(FAERS)数据库中与药物相关的急性肾损伤(AKI)发生率。 研究目的:AKI是一种与透析、慢性肾病和死亡的短期和长期后果相关的常见疾病。尽管FDA的 FAERS数...
-
FDA新药审批黑幕曝光 一世英名尽毁于一旦
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论新药审评是美国食品药品监督管理局(FDA)的重要职能之一。在美国,任何新的处方药在被批准用于患者之前,均要经过FDA的一项广泛审查和批准程序。俗话说,有权力的地方就会有利益。近日,《科学》杂志网站发布了一篇研究报告——《隐藏的冲突?》,指出被...
-
很多新药和生物制剂上市后未按照FDA要求完善信息!
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论2018年5月,发表于《BMJ》上的一项横断面分析,应美国食品药品监督管理局(FDA)要求,对2009和2012年间批准的新药和生物制剂进行上市后研究。 目的:描述FDA批准的新药和生物制剂的上市后要求,并考察注册率和及时性、结果报告和公布的前瞻性队列研究、注册和临床试...
-
FDA批准心血管药物的临床试验:女性患者的代表性问题
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论2018年5月,发表在《J Am Coll Cardiol》的一项由美国研究者进行的研究,考察了支持美国食品和药物管理局(FDA)批准心血管药物的临床试验中,女性的参与情况。 背景:有一种担忧认为,在心血管药物试验中,女性的代表性不足。 目的:作者旨在考察提交给FDA并支持药...
-
FDA批准的抗癌新药 一半以上然并卵
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论抗癌新药上市一直是医药行业最为关注的问题之一。为了让新药尽快来到患者身边,美国食品和药物管理局(FDA)启动了优先审评与突破性疗法认定等一系列政策,加速这些新药上市的过程。近几年来,FDA的审批速度总体而言很快,可谓成绩斐然。然而,审批过快会不会出现浑...
-
NCCN推荐抗癌药物适应症的范围超过了FDA批准!
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论2018年3月,发表于《BMJ》上的一项回顾性观察研究,表明了美国国家综合癌症网络(NCNN)指南推荐意见的频率和证据水平超出美国食品药品监督管理局(FDA)的批准。 目的:考察NCNN指南和FDA有关抗癌药物批准的推荐意见之间的差异,由NCCN引用的证据判断存在差异的推荐...
-
FDA新批准:治疗非小细胞肺癌 药又多一例
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论根据美国国立卫生研究院(NIH)国家癌症研究所的数据,肺癌是美国癌症死亡的主要原因,据估计,2017年新增诊断222500例,死亡155870例。当癌细胞在肺组织中形成时,作为肺癌最常见的类型,NSCLC产生了。在治疗中,分子靶向疗法和免疫疗法表现出喜人的疗效,尤其在201...
-
揭秘首个FDA批准的遗传性乳腺癌创新药!
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论乳腺癌是最常见的癌症形式,严重威胁着女性的健康和生命。据美国国立卫生研究院(NIH)的国家癌症研究所估计,仅在美国,今年约有252710名女性被诊断为乳腺癌,其中40610人将死于此病。近日,美国食品和药物管理局(FDA)扩大了一种多聚二磷酸腺苷核糖聚合酶(PARP)...
-
FDA批准冲击波装置 专攻难治愈的糖尿病足
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论糖尿病作为一大难治愈疾病,不仅对患者的生活质量造成影响,其并发症还时时威胁患者的生命。糖尿病患者因为本身高糖水平的身体环境,常使炎性细胞趋化及吞噬作用下降,一旦发生皮肤破损,细菌不易被清除,伤口难以愈合。针对糖尿病患者的这一苦恼,近日,美国食品和...
-
乳腺癌患者的专属定向放疗系统获FDA批准啦!
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论乳腺癌作为女性头号杀手,每年杀死大约50万的女性,全球每26秒就有一例女性乳腺癌病例。乳腺癌对女性的伤害不仅是疾病本身,还有因治疗引起的严重副作用。作为癌症患者主要的治疗方式之一,放疗易造成皮肤起泡、恶心、呕吐等副作用。为了杀死癌细胞,患者必须承受可...
-
基因疗法也能用于失明?首例已获FDA批准
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论美国食品和药物管理局(FDA)近日批准了一种新的基因疗法用于治疗遗传性视力丧失的儿童和成人患者,这些患者最终可能失明。该疗法是美国批准进行的第一个靶向特定基因突变引起的疾病的基因治疗。 该疗法被批准用于治疗具有确诊的双等位基因RPE65突变相关性视网膜营养...
-
FDA批准EGPA首个治疗药物
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论美国食品和药物管理局(FDA)近日宣布扩大美泊利单抗的获批使用,用于治疗嗜酸性肉芽肿性多血管炎(EGPA)——能造成血管炎的罕见自身免疫疾病。这一新的适应证提供了治疗EGPA的首个FDA批准疗法。 据国立卫生研究院(NIHA),EGPA(曾叫Churg-Strauss综合...
-
FDA批准首个短效“后续”胰岛素产品
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论美国食品和药物管理局(FDA)近日批准赖脯胰岛素注射液(短效胰岛素)用于改善1型糖尿病成人和≥3岁儿童患者和2型糖尿病成人患者的血糖控制。这是首个批准的短效胰岛素“后继”产品[通过FDA的505(b)(2)通道提交申请]。 根据美国疾病预防和控制中心(CDC...
-
FDA批准阿片类使用障碍的药物辅助治疗
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论日前,美国食品和药物管理局(FDA)批准首个每月一次注射丁丙诺啡制剂用于治疗中至重度阿片类药物使用障碍(OUD)的成年患者,这些患者初始已经使用含丁丙诺啡的透粘膜(通过粘膜吸收)制剂。其适用于经稳定剂量丁丙诺啡治疗至少7天的患者。 用于OUD治疗的丁丙诺啡当...
-
FDA批准首款可术后调整晶状体
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论日前,美国食品和药物管理局(FDA)批准了首个可在白内障手术后对人工晶状体的功率进行微调的医疗设备系统,以便当患者不使用眼镜时将有更佳的视力。 白内障是常见的眼部疾病,导致天然晶状体变混浊,损害患者视力。白内障手术后,在此期间已变得浑浊的眼睛的天然晶...
-
FDA批准首款双药HIV疗法
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论日前,美国食品和药物管理局(FDA)批准了首个用于治疗人类免疫缺陷病毒1型(HIV-1)特定成年患者的完整的治疗方案。该方案仅包含2种药物,而非3种或更多的标准HIV治疗药物。 此治疗方案是一种包括2种既往批准药物(度鲁特韦和利匹韦林)的固定剂量片剂,用于治疗目...
-
人工耳蜗也有了远程医疗 还获得FDA批准
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论日前,美国食品和药物管理局(FDA)批准了一项远程医疗方案,即通过远程医疗平台进行Nucleus人工耳蜗植入系统的后续编程。该远程编程功能适用于已经植入人工耳蜗声音处理器6个月并且对编程过程感到满意的患者。 FDA医疗器械和放射健康中心眼、耳、鼻、喉部门主任Malv...
-
FDA扩大舒尼替尼适应症 减少肾癌复发风险
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论日前,美国食品和药物管理局(FDA)批准舒尼替尼用于辅助治疗肾脏已被切除(肾切除术)后肾癌(肾细胞癌)复发高风险成年患者。辅助治疗是在初次手术切除后采取的一种治疗形式,以降低癌症复发风险。 FDA肿瘤卓越中心主任、FDA药物评价和研究中心血液和肿瘤产品办公...
-
FDA批准电刺激装置 减轻阿片类药物戒断症状
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论美国正经历空前的阿片类药物滥用危机,总统特朗普甚至称其为“国家的耻辱”、“人类的悲剧”。为了应对这一问题,美国当局采取种种措施缓解阿片类药物滥用的情况,其中包括新药物和新技术的开发。近日,美国食品和药物管理局(FDA)批准了一种新...
-
FDA批准预防巨细胞病毒感染新药
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论近日,美国食品和药物管理局(FDA)批准美国某知名药企的letermovir用于预防巨细胞病毒感染(CMV)和接受异基因造血干细胞移植(HSCT)的成人的疾病。 FDA批准letermovir每日一次口服片剂和静脉输注注射剂,尤其对于异基因HSCT的成人CMV-血清反应阳性受者[R+]。 CMV...
-
经FDA快速审批的新药标签安全性相关内容的改变率更…
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论2017年9月,发表在《BMJ》上的一项回顾性队列研究,考察了经美国食品和药品监督管理局(FDA)快速审批的药物的标签安全性相关的内容改变发生率情况。研究结果表明:通过快速审批途径获批的药物与上市后安全性相关的标签改变的增加相关,尤其是代表最高风险警告的改变...
-
65万余支不合格疫苗流入三省 CFDA回应
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论最近几天,相信不少家长的朋友圈都被“65万余支不合格百白破疫苗流入三省”的新闻刷屏了。最近几年不时出现的疫苗安全事件总能轻易地牵动人们脆弱的神经,一次又一次的疫苗安全事件为何时不时发生? 据悉,百白破疫苗是预防百日咳、白喉、破伤风的有效手段...
-
FDA加速批准acalabrutinib用于治疗套细胞淋巴瘤
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论日前,美国食品和药物管理局(FDA)加速批准acalabrutinib用于治疗既往接受至少一次治疗的套细胞淋巴瘤成年患者。FDA药品评价和研究中心Richard Pazdur博士表示,套细胞淋巴瘤是一种特别具有侵袭性的癌症。对于对治疗无响应或复发的患者,acalabrutinib提供了一种新...
-
FDA批准利伐沙班标签更新
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论近日,美国食品和药物管理局(FDA)批准某德国知名药企与合作伙伴某美国综合性医疗保健企业更新Xa因子抑制剂利伐沙班的标签,纳入10 mg每天一次剂量,用于美国复发性静脉血栓栓塞(VTE)的延长治疗。标签更新用于已经接受至少6个月标准抗凝治疗的处于深静脉血栓(DVT...
-
FDA批准“最昂贵”药物用于治疗重症肌无力
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论美国食品和药物管理局(FDA)近日批准依库丽单抗(eculizumab)作为抗乙酰胆碱受体(AChR)抗体阳性的全身性重症肌无力(gMG)成年患者的治疗药物。相关的3期REGAIN研究结果发表在20日的《The Lancet Neurology》杂志上。 3期REGAIN研究的主要研究者、美国北卡罗来纳...
-
FDA批准首款智能手机兼容的可植入心脏监测仪
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论心脏病患者可以用手机连续监测自己的心律情况了!近日,美国食品和药物管理局(FDA)批准通过了一款新的可植入心脏监测仪,这是世界上首款智能手机兼容的可植入心脏监测仪,旨在帮助医生远程识别患者的心律失常。该技术提供了一种监测异常心律的新方法,同时能将监测...
-
FDA扩大优特克单抗适应症
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论美国食品和药物管理局(FDA)近日宣布,批准扩大某全球多元化医疗卫生保健品公司的优特克单抗(ustekinumab)的适应症,用于治疗可接受光疗或全身性治疗的中度至重度斑块型银屑病青少年(年龄≥12岁)。20岁以下的斑块型银屑病患者中,青少年约占1/3且治疗选择有限...
-
FDA批准首个NHL特定类型的疗法
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论美国食品和药物管理局(FDA)日前批准基于细胞的基因疗法axicabtagene ciloleucel治疗至少两类其他治疗后无应答或复发的大B细胞淋巴瘤特定类型的成人患者。此疗法为嵌合抗原受体(CAR)T细胞疗法,是FDA批准的第二个基因疗法和第一个非霍奇金淋巴瘤(NHL)特定类型的...
-
新辅助装置获FDA许可 微创手术更容易
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论解放外科医生、提高手术的精准度是发展医疗技术的一个目标方向。近日,美国食品和药物管理局(FDA)批准许可了一种新的机器人辅助手术装置(RASD),可帮助促进微创手术。 FDA设备与放射卫生中心的外科手术部主任Binita Ashar博士说,微创手术有助于减轻手术后的疼痛...
-
FDA批准中枢性睡眠呼吸暂停新治疗方法
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论近日,美国食品和药物管理局(FDA)批准了中度至重度中枢性睡眠呼吸暂停患者的新治疗方案。Remedē系统是一种植入式装置,可刺激位于胸部的神经,该神经负责向隔膜发送信号以刺激呼吸。 FDA医疗器械和放射健康中心Tina Kiang表示,该植入式装置为患者提供了中枢性睡...
-
FDA批准连续葡萄糖监测系统 无需手指取血校准
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论近日,美国食品和药物管理局(FDA)批准了FreeStyle Libre Flash葡萄糖监测系统,该系统是首个用于成年患者糖尿病治疗决策的连续葡萄糖监测系统,且无需手指取血(通常称为“手指针刺”)校准。 该系统通过使用插入皮肤表面下方的小型传感器导线连续测量和...
-
FDA批准纳武单抗新适应症
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论近日,美国食品和药物管理局(FDA)批准纳武单抗静脉注射用于治疗既往接受索拉非尼治疗的肝细胞癌(HCC)患者。此适应症的加速审批基于肿瘤缓解率和缓解的持久性。 此药的警告和预防包括:免疫介导性肺炎、结肠炎、肝炎、内分泌病、肾炎和肾功能障碍、皮肤不良反应、...
-
FDA批准pembrolizumab新适应症
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论美国食品和药物管理局(FDA)近日批准美国某药企的pembrolizumab(抗PD[程序性死亡受体]-1治疗)用于治疗复发性局部晚期或转移性胃癌或FDA批准的一项测试确定的肿瘤表达PD-L1[联合阳性评分(CPS)≥1]的胃食管连接部(GEJ)腺癌,≥2个既往治疗(包括氟嘧啶和含...
-
鼻息肉患者的好消息 FDA批准一款鼻用喷剂
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论近日,美国食品和药物管理局(FDA)批准某美国药企的一种药物(研发期间名为OPN-375)用于治疗≥18岁患者的鼻息肉。 美国有高达1000万人患鼻息肉,受症状困扰。 宾夕法尼亚大学鼻科学系教授和主任James Palmer说,这是一个严重的疾病,由于炎症造成非常大的痛苦。...
-
FDA批准首个携带一次性帽的十二指肠镜
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论日前,美国食品和药物管理局(FDA)批准首个携带一次性使用远端帽的十二指肠镜,其能减少设备污染,降低传播致命抗生素耐药感染的威胁 该新型十二指肠镜设计用于可视化上消化道,以诊断和治疗胆汁和胰管疾病。 十二指肠镜由于其许多小而难以到达的部件而难以清洁和消...
-
FDA批准三联方案吸入器治疗COPD
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论日前,美国食品和药物管理局(FDA)批准每日1次、单次吸入器三联方案糠酸氟替卡松/芜地溴铵/维兰特罗(fluticasone furoate/umeclidinium/vilanterol)用于治疗慢性阻塞性肺病(COPD)患者。 经批准的适应症包括慢性支气管炎和/或肺气肿,不包括急性支气管痉挛或哮喘...
-
FDA批准copanlisib治疗成人复发性滤泡淋巴瘤
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论美国食品和药物管理局(FDA)近日加速批准了德国某知名企业的药物copanlisib用于治疗已经接受至少2次全身性治疗的复发性滤泡淋巴瘤成人患者。 FDA肿瘤学卓越中心主任、FDA药物评价与研究中心血液和肿瘤产品办公室代理主任Richard Pazdur说,对于复发性滤泡淋巴瘤患者...
-
癫痫患者的福音 布瓦西坦单一疗法获FDA批准
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论癫痫病属于一种需要长期治疗的慢性疾病,可见于各个年龄段。儿童癫痫发病率较成人高,随着年龄的增长,癫痫发病率有所降低。给患者的身心造成的危害很大。近日,一则消息又为癫痫患者带来了好消息。 9月15日,美国食品和药物管理局(FDA)已经批准了某公司的布瓦西坦...
-
FDA批准塞克硝唑治疗女性细菌性阴道炎
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论近日,美国食品和药物管理局(FDA)批准了一种名叫塞克硝唑(secnidazole)的抗菌药物用于治疗女性细菌性阴道炎。 根据疾病控制与预防中心,塞克硝唑是首个针对细菌性阴道炎(15~44岁女性最常见的阴道感染)的单剂量口服治疗药物。 一个剂量的塞克硝唑以2g颗粒包装...
-
FDA批准首个磷酸奥司他韦口服混悬剂
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论日前,美国食品和药物管理局(FDA)已经批准了首个磷酸奥司他韦口服混悬剂[6mg(base)/mL]仿制药。 FDA表示,该仿制药对于不能摄取胶囊的患者尤为重要。 用于口服混悬剂的磷酸奥司他韦包括三种剂量,即30mg、45mg和75mg,用于流感症状不超过48小时的≥2周的患者。...
-
FDA加速批准药物的预批准研究和批准后研究有无差别?
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论2017年8月,发表在《JAMA》的一项研究调查了美国食品药物管理局(FDA)加速批准授权药物预批准和批准后研究的特点。研究结果显示,验证性试验和预批准试验具有相似的设计元素,加速批准授权药物的有效性通常在批准后3年内的批准后研究中得到证实。 重要性:治疗严重...
-
什么情况?CAR-T疗法临床研究被FDA叫停
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论面对各国对新药、新技术安全性及有效性越来越高的要求,一些研发机构或公司对于临床试验的投入也不得越来越多,不得不越来越规范,并且随时会面临着被叫停的可能。当然这是好的,无论是对于人类的健康还是医药的发展。近日,某公司的CAR-T细胞疗法就被叫停了,为什么...
-
基因疗法治疗EB获FDA突破性疗法认定
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论大疱性表皮松解症(epidermolysis bullosa,EB)是一类可能危及生命的遗传性皮肤病。日前,治疗该病的基因疗法EB-101获得美国食品和药物管理局(FDA)授予的突破性疗法认定。 据悉,EB-101是一种自体同源、通过将COL7A1基因导入自体同源角质细胞的ex-vivo(ex-vivo指...
-
开创历史!FDA批准首个基因疗法治疗ALL
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论日前,美国食品和药物管理局(FDA)进行了一项历史性的行动,使美国首个基因治疗方法获批,从而开拓了新的治疗癌症及其他严重和危及生命疾病的方法。 FDA批准tisagenlecleucel用于急性淋巴细胞白血病(ALL)儿童和年轻成年患者。 FDA专员Scott Gottlieb表示,基因和...
-
FDA批准新的抗菌药物用于成人复杂性尿路感染
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论日前,美国食品和药物管理局(FDA)批准Vabomere用于成人复杂性尿路感染(cUTI),包括由特定细菌引起的一种肾脏感染即肾盂肾炎。这是一种含有美罗培南(一种抗菌剂)和vaborbactam的药物。Vaborbactam可抑制细菌使用的某些类型的抗性机制。 FDA药品评价与研究中心抗...
-
FDA批准美国首个恰加斯病治疗药物
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论美国食品和药物管理局(FDA)已经加速批准苄硝唑用于治疗患有恰加斯病的2~12岁儿童,成为美国批准用于这种罕见病的首个治疗方法。 恰加斯病或南美洲锥虫病是由克氏锥虫引起的寄生虫感染。其可以通过不同的路径传播,包括与某些昆虫的粪便接触、输血或怀孕期间由母亲...
-
FDA批准免疫球蛋白用于狂犬病治疗
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论日前,美国食品和药物管理局(FDA)已经批准了人血浆衍生的狂犬病免疫球蛋白用于狂犬病感染被动、短期暴露后预防。 在与患狂犬病或可能患狂犬病的动物接触之后应立即给予此药,同时使用完整疗程的狂犬病疫苗。疫苗治疗开始后,不应该施用重复剂量的此药,因为它们可...
-
老树开新花!金刚烷胺新用途获FDA批准
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论帕金森病(PD)是一种常见的慢性神经退行性疾病,伴随治疗药物的使用,产生的运动障碍也成为了众多帕金森患者的困扰。克服运动障碍对于PD患者来说,不仅是身体的解放,更是心理上的一种解放。帕金森病人的福音来了。近日,美国食品和药物管理局(FDA)批准金刚烷胺(...
-
膳食补充剂于保健无益 市场乱象FDA监管不力
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论曾几何时,市场上开始充斥着形形色色的营养品和食品补充剂。随着经济水平的提高,在一些“营养专家”的鼓吹下,很多家庭把这些食品补充剂列为日常必需品,以期获得更健康的体魄。然而,越来越多的研究证明,大部分食品补充剂对正常人没有什么作用,相反,...
-
FDA批准“最小”MR兼容CRT起搏器
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论根据医疗设备制造商,美国食品和药物管理局(FDA)日前批准了最小的磁共振(MR)条件下的四极心脏再同步起搏器。 Edora HF-T QP的体积为15cc,电池寿命近10年,降低了心衰患者医疗设备更换的频率。 新的起搏器具有MRI AutoDetect功能,当患者进入MR成像环境时,其允...
-
Gardasil 9获FDA批准 可预防90%宫颈癌
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论2014年12月,FDA批准了人乳头状瘤病毒[HPV] 9价重组疫苗用于预防9型HPV病毒引起的某些疾病。新疫苗比既往批准的Gardasil制剂多出5种HPV类型。相关报告见发表在2015年4月的《Cancer.》。 新疫苗可预防约90%的宫颈癌及相关癌症 新疫苗被批准用于9~26岁的女性和9~15岁...
-
FDA批准新药 为罕见白血病患者“保驾护航”
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论“孤儿药”又称为罕见药,因其患病人群少、市场需求小、研发成本高等问题很少引起制药企业的关注。但是这些罕见病常存在高风险,患者的生活质量和生存难以得到保障。为了挽救这些生命,许多国家纷纷颁布政策扶持药企研发“孤儿药”。近日,美国...
-
FDA雇佣新规使外籍科学家留美难 欠妥!
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论当今社会越来越国际化。在崇尚自由、民主的美国,不少大企业都雇佣着数量可观的外籍工作人员。不少科研机构外籍科学家更是占据一定数量。不过最近,有媒体曝出美国食品和药物管理局(FDA)将要实施一项新的雇佣法案:将不会把工作邀约发给在过去5年时间中在美国的生...
-
减肥黑科技遭FDA调查 胃气球植入靠不靠谱?
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论自1975年以来,肥胖男性的比例已经翻了三倍,而女性增加了一倍多。按照这个趋势,预计到2025年,大约有五分之一的人口是肥胖或超重的。在众多国家中,我国和美国是肥胖的重灾区,有越来越多的人因肥胖而产生心血管疾病或糖尿病等并发症。然而,选择一款安全、有效、...
-
美华裔医生推广“三父母”婴儿技术 FDA发警告
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论试管婴儿不是新鲜事,但目前全球允许“三父母”婴儿基因技术(Three-parent baby)的仅有英国。近日,美国食品和药物管理局(FDA)对积极推广未经批准的该技术的美国华裔医生张进(John Zhang)发出警告,认为他将此基因技术向市场推广是违法的,要求他停...
-
FDA批准丙肝新药 治疗仅需8周
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论日前,美国食品和药物管理局(FDA)批准了Mavyret(glecaprevir和pibrentasvir)用于治疗无肝硬化(肝病)或轻度肝硬化的慢性丙型肝炎病毒(HCV)基因型1-6成年患者,包括中重度肾病患者和处在透析状态的患者。在既往应用含NS5A抑制剂或NS3/4A蛋白酶抑制剂但非同时使...
-
FDA批准依鲁替尼用于治疗慢性移植物抗宿主病
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论近日,美国食品和药物管理局(FDA)批准依鲁替尼(Imbruvica)用于治疗一项或多项治疗失败后的慢性移植物抗宿主病(cGVHD)成年患者。这是FDA首次批准用于cGVHD的治疗。 cGVHD是一种危及生命的病症,可以在患者从血液或骨髓接受干细胞移植[称为造血干细胞移植(HSCT...
-
FDA批准nivolumab新适应症
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论近日,美国某从事医药保健及个人护理产品的多元化企业宣布,美国食品和药物管理局(FDA)已经加速批准nivolumab静脉注射用于治疗微卫星不稳定性高(MSI-H)或错配修复缺陷(dMMR)的转移性结直肠癌(mCRC)成人和儿童(≥12岁)患者(在氟嘧啶、奥沙利铂和伊立替康...
-
这一关节炎药物让FDA很“头疼”
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论美国某综合性医药保健公司的研究性类风湿性关节炎(RA)治疗受到美国食品和药物管理局(FDA)顾问小组的严厉批评。 在上月末发布的简报中,FDA小组提出了RA药物sirukumab的安全性问题。在评论中,FDA说,在服药52周的患者中,死亡和恶性肿瘤明显不平衡。小组指出,与...
-
FDA批准用于难治性疼痛的无创装置
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论近日,美国食品和药物管理局(FDA)批准了一种无创的神经调节装置(Stimpod NMS460)用于缓解慢性难治性疼痛。 该装置所在企业首席执行官Corlius Birkill表示,这项突破性的技术有能力帮助数十万甚至数以百万计的美国人,成为神经科医师、按摩医师、针灸师、物理治疗...
-
FDA批准AML新靶向治疗药物
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论近日,美国食品和药物管理局(FDA)批准enasidenib用于治疗具有特异基因突变的复发性或难治性急性髓性白血病(AML)成年患者。该药物被批准用于伴随诊断,即RealTime IDH2 Assay,其用于检测AML患者中IDH2基因的特异性突变。 FDA药品审评和研究中心肿瘤卓越中心主任...
-
FDA发文详细介绍首个新生儿MRI设备
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论近日,美国食品和药物管理局(FDA)明确了在新生儿重症监护室(NICU)中专门用于新生儿大脑和头部成像的首个磁共振成像(MRI)设备。 FDA设备和放射卫生中心儿科和特殊人群首席医疗官(CMO)Vasum Peiris说,尽管我们可以使用传统MRI扫描仪进行新生儿成像,把孩子带...
-
FDA批准针对未治愈丙肝的新型复方药片
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论丙型肝炎是一种引起肝脏炎症的病毒性疾病,可能导致肝功能减退或肝衰竭。据2016年的统计数据,全球有1.3至1.5亿丙肝患者。中国慢性丙肝患者约为1000万人,其中250万人急需治疗。针对那些之前用抗病毒药物未治愈的丙肝患者,美国食品和药物管理局(FDA)近日批准了一...
-
FDA批准降低乳腺癌复发风险的新药
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论美国食品和药物管理局(FDA)日前批准来那替尼作为早期HER2阳性乳腺癌的扩展辅助治疗。来那替尼是此类癌症患者的首个扩展辅助治疗(初始治疗后进行的进一步降低癌症复发风险的治疗形式)。来那替尼用于既往接受治疗(包括药物曲妥珠单抗)的成人患者。 FDA肿瘤研究中...
-
血液恶性肿瘤治疗曙光 新药获FDA全票推荐批准
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论血液恶性肿瘤领域迎来曙光!7月12日,首个基于嵌合抗原受体(CAR)T细胞的产品接受审议,美国食品和药物管理局(FDA)专家组一致推荐批准。全部10名小组成员在FDA肿瘤药物咨询委员会会议上投赞成票,无人弃权,也无人反对推荐批准。 此药之前叫CTL019。 投票后评论中...
-
控制速释阿片类药物处方 FDA让药企付出代价
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论旨在控制速释(IR)阿片类药物处方,美国食品和药物管理局(FDA)正在强制药品生产商为开具这些药物处方的医生提供培训并为培训付费。相同的限制已经用于阿片类药物的缓释(ER)配方。 在FDA关于药物滥用的一次会议上,FDA局长Scott Gottlieb说,美国全部阿片类药物...
-
FDA批准近20年来首个镰状细胞病新药
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论美国食品和药物管理局(FDA)已经批准L-谷氨酰胺口服粉剂缓解≥5岁镰状细胞病患者的严重并发症。这是近20年来该罕见病获批的首个药物。 在一项随机试验中考察此药的安全性和有效性。在被纳入试验前12个月内,年龄5~58岁的患者已经经历≥2次镰状细胞病疼痛危象。...
-
FDA批准新的“弹性”人工心脏瓣膜
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论根据医疗器械制造商的说法,美国食品和药物管理局(FDA)日前批准了一种新的人工生物心脏瓣膜(Inspiris Resilia),专为为潜在的将来的瓣膜-瓣膜手术而设计。 该心脏瓣膜被描述为“一类新型弹性心脏瓣膜”中的第一款,其特征是采用称为Resilia的新型牛组...
-
再也不用担心化疗脱发 FDA批准冷冻帽扩展使用
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论日前,美国食品和药物管理局(FDA)批准一种冷冻帽(一种冷却系统)扩展使用,用以减少化疗期间的脱发。这是该机构为实体肿瘤癌症患者批准使用的首个冷冻帽。 FDA医疗器械和放射健康中心的手术器械部门负责人Binita Ashar表示,我们很高兴将这种产品用于实体瘤癌症患...
-
惊!32%FDA批准新药受到了上市后安全性事件影响
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论当新药和生物制剂被监管部门最初批准后出现新的安全性风险时,上市后的安全性事件就会发生。这些安全性事件可以改变新的治疗药物在临床实践中的使用,并影响患者和临床医生的决策。2017年5月,发表在《JAMA》的一篇文章调查了美国食品和药品监督管理局(FDA)2001~20...
-
FDA批准VNS治疗用于癫痫发作
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论日前,美国食品和药物管理局(FDA)已批准一种迷走神经刺激(VNS)治疗(VNS治疗)系统用作辅助治疗,以减少4岁及以上抗癫痫药物难以治愈的部分性癫痫发作患者的癫痫发作频率。 既往,VNS治疗被批准用于12岁以上的儿童。据介绍,VNS治疗是通过一种装置递送,该装置通...
-
FDA批准检测白血病和淋巴瘤的试剂上市
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论日前,美国食品和药物管理局(FDA)批准ClearLLab试剂(T1,T2,B1,B2,M)上市。这是首个用于流式细胞术使用的授权测试,可帮助检测某些白血病和淋巴瘤,包括慢性白血病、急性白血病、非霍奇金淋巴瘤、骨髓瘤、骨髓增生异常综合征(MDS)和骨髓增生性肿瘤(MPN)。...
-
FDA批准贝曲西班用于VTE预防
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论近日,美国食品和药物管理局(FDA)已经批准新型口服抗凝剂贝曲西班(betrixaban)用于由于中度或重度移动受限及其他静脉血栓栓塞(VTE)风险因素而处于血栓栓塞并发症风险的住院急性危重患者的VTE预防。 上述药品所属医药企业表示,贝曲西班是该患者群体中第一个也...
-
FDA批准预防遗传性血管性水肿发作的孤儿药
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论遗传性血管性水肿(HAE)患者迎来福音!美国食品和药物管理局(FDA)6月22日批准了首个C1酯酶抑制剂(人)皮下注射预防青少年和成人HAE发作。皮下注射的方式经过适当练习,可使患者或护理者在家自我注射更简单。 HAE由血浆蛋白——C1酯酶抑制剂(或C1-INH...
-
FDA批准阴道炎常见病因全新分子检测
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论约翰霍普金斯大学的研究人员报告,一种分子诊断测试可准确地区分阴道炎的3个最常见病因。6月8日发表在《Obstetrics & Gynecology》的一篇论文中,研究人员称,新测试基于细菌遗传印记的出现——酵母菌和原生毛滴虫,和传统实验室检测一样准确且更客观...
-
抗菌皂不能抗菌?FDA禁止19种抗菌成分
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论近年来宣称含有抑菌成分的产品广泛渗透到人们的日常生活中,最具代表性的就是抗菌皂。然而,在2016年的DIOXIN国际研讨会中,200多名科学家和医学专业人士共同声明,所谓的抗菌产品不仅无法预防疾病,还可能会对人类健康和自然环境造成伤害。 早在2016年9月,美国食品...
-
耗时17年 新型抗生素终获美FDA批准
环球医学资讯

 1小时条评论
1小时条评论俗话说,十年磨一剑。近日,一种新型抗生素Delafloxacin,历经17年的研发与等待后才获得了FDA的批准,用于治疗由易感细菌引起的急性细菌性皮肤和皮肤结构感染(ABSSSI)。 由于抗生素耐药性提高,由耐甲氧西林金黄色葡萄球菌(MRSA)导致ABSSSI发病率、并发症和住院...
-
FDA力挺利拉鲁肽有心血管获益
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论美国食品和药物管理局(FDA)内分泌和新陈代谢药物咨询委员会以压倒性的投票推荐利拉鲁肽注射液的附加指征——2型糖尿病(T2DM)和高心血管风险成人中,旨在降低主要不良心血管事件(心血管死亡、非致死性心肌梗死或非致死性卒中)风险的心血管风险因素的...
-
FDA将对移动健康应用监管史无前例大松绑
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论近年来,移动健康领域已经成为社会各界关注的热点,“指尖上的医疗”迎来滚烫的热度。据估计,2016年在苹果和安卓的应用商店上有165000个与健康相关的APP应用。6月15日,年仅44岁的美国FDA新掌门Scott Gottlieb在FDA官网发布博文,说明了一项FDA即将实施的...
-
FDA:新配方盐酸氢羟吗啡酮(Opana ER)在美退市
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论近日,美国食品和药品监督管理局(FDA)在其网站上发布消息,要求制药企业从市场中撤回阿片类止痛药,新配方盐酸氢羟吗啡酮(Opana ER )。 FDA表示:由于担心该药物所获得的临床益处可能不会超过它带来的风险,经过慎重考虑,决定让该药退出市场。这是FDA首次因考虑药...
-
FDA扩大第三代人工心脏瓣膜适应症
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论近日,美国食品和药物管理局(FDA)扩大了Sapien 3经导管心脏瓣膜(THV)的适应症,用于患有症状性心脏病的患者。这些患者因为既往放置生物假体主动脉瓣或二尖瓣失败,其死亡或重复手术严重并发症的风险高。 FDA器械和放射健康中心心血管器械司主任Bram Zuckerman教...
-
FDA批准首个用于过敏性结膜炎的局部滴眼液
环球医学资讯

 1小时条评论
1小时条评论西替利嗪是与组胺受体位点竞争性结合以减少肿胀、瘙痒和血管舒张的第二代抗组胺药(H1受体拮抗剂)。日前,美国食品和药物管理局(FDA)已经批准了抗组胺药西替利嗪作为首个局部眼部制剂用于治疗与过敏性结膜炎相关的眼部瘙痒。 据悉,西替利嗪眼用溶液0.24%(Zervia...
-
FDA批准首个专门治疗巨细胞动脉炎的药物
环球医学资讯

 1小时条评论
1小时条评论近日,美国食品和药物管理局(FDA)扩大了托珠单抗的适应症,用于治疗成人巨细胞动脉炎。这是FDA批准的针对这一新的适应症(这种类型的血管炎)的首个治疗。 FDA药物评价和研究中心肺、过敏风湿病产品部门的主任Badrul Chowdhury表示:我们之所以加快这一申请的开发...
-
FDA批准全球首个以肿瘤生物标志物为适应症的肿瘤治…
环球医学资讯

 1小时条评论
1小时条评论近日,美国食品和药物管理局(FDA)批准了针对肿瘤生物标志物为适应症的全球首个癌症治疗药物--- pembrolizumab。 Pembrolizumab用于治疗与高度微卫星不稳定性(MSI-H)或错配修复缺陷(dMMR)生物标志物相关的成人和儿童不可切除或转移性实体瘤的患者。该适应症涵盖...
-
纳尼?三分之一FDA批准药物存在安全隐患!
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论美国FDA是公认的国际医疗审核权威机构。近日发表在《JAMA》上的一项美国耶鲁大学研究人员领导的研究显示,由FDA批准的药品中,近三分之一存在安全隐患。 研究人员分析了2001年至2010年间FDA批准的新药数据,并对这些药品上市后的使用情况进行了持续跟踪。他们发现,3...
-
伙同情妇敛财不停 原CFDA高官获刑10年
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论一直以来,反腐力度不减,让人拍手称快。不管腐败者是个人行为,还是集体性的网络化行为,只要凡贪必查,凡腐必纠,民众看到了反腐败的威力和决心,对反腐败以及权力廉洁就会产生更多信心与期待。近日,二中院一审以受贿罪,判处国家食品药品监督管理总局(CFDA)医...
-
CFDA:临床试验数据造假如何处罚?
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论4月10日,国家食品药品监督管理总局(CFDA)发布《关于药物临床试验数据核查有关问题处理意见的公告(修改稿)》,并再次向社会公开征求意见,意见反馈时间截至4月21日。据悉,2016年8月19日至9月18日,该局首次就处理意见向社会公开征求意见期间,共收到反馈意见280...
-
“白帽子黑客”问题愈发凸显 FDA再发新规
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论近年来,医疗设备网络安全问题愈发凸显。据外媒报道,当地时间2016年12月27日,美国食品与药物管理局(FDA)公布了关于医疗设备制造商如何维护联网设备安全的建议文件,即新版《医疗设备网络安全规则》,告知制造商、供应商和医疗机构,请做好安全防护措施和必备工作...
-
有健康风险!FDA禁用医用有粉手套
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论美国FDA近日宣布,从2017年1月19日开始在全美禁用医用有粉手套。FDA在3月提出了这一禁令,原因是这些手套会给医生和患者带来“不合理与切实的”的健康风险。这是FDA在1983禁用人造毛纤维后第二次禁止的医疗设备。 FDA发表声明说,这一禁令适用于有粉外科手...
-
FDA也玩标题党 “突破疗法”名不副实
环球医学资讯

 1小时条评论
1小时条评论标题党为了追求点击量,夸大其词或断章取义是其常用的手法。而全球享有盛名的美国食品药品监督管理局(FDA)身上,最近也深陷“标题党”风波。2012年,FDA对药物研发创建了一个新的标签——“突破”。但具有讽刺意义的是,很多认定为&...
-
口服双膦酸盐和艰难梭菌感染风险:FDA不良事件报告…
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论研究显示,艰难梭菌感染(CDI)和包括质子泵抑制剂、骨质疏松症药物和抗抑郁药在内的非抗菌药物之间存在相关性。2016年10月,发表在《Pharmacotherapy》的一项研究评价了美国食药监局不良事件报告系统数据库(FAERS)中口服双膦酸盐和报告的CDI 药物不良反应。 目的...
-
华法林剂量调整:扩大的基于药物基因组学的CPMC-WD…
环球医学资讯

 1小时条评论
1小时条评论美国食品和药物管理局(FDA)香豆素药物标签广泛用于华法林剂量调整。2016年8月,发表在《Thromb Haemost》的一项研究表明,一个扩大的基于药学基因组学CPMC-WD表比FDA表预测治疗剂量更为精确。 采用一个综合性给药公式,药物基因组学(PGx)指导华法林给药可能会优...
-
FDA权威性受挑战 涉嫌篡改专家信息
环球医学资讯

 1小时条评论
1小时条评论医药界人士都知道,美国FDA是国际上最具权威的医疗审核机构,其下属的专家委员对新药的评审和投票更被认为是世界最高检测标准。然而,正是这个委员会最近给FDA惹来了一场官司。 FDA通常会聘用外部专家组成专家委员会以对申报的新药做出评审和投票。FDA的审批者通常都...
-
FDA自说明书中撤除黑框警告的伦理与临床考虑
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论FDA黑框警告的制定是基于FDA对收到的上市后不良事件报告的评估,目前常用于医药方面的警告信息,警示人们用药后的风险增加。2016年6月发表在《Drug Saf》的一项在美国开展的研究考察了FDA自说明书中撤除黑框警告的伦理与临床考虑。 黑框警告(Boxed warnings或black ...
-
FDA药品召回主要有哪些常见的原因?
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论2016年2月,发表于《Am J Health Syst Pharm》的一项研究分析了FDA药品召回的特征和主要原因。结果显示,FDA药品召回的5个最常见的召回原因是污染、标记错误、不良反应、不合格产品和药效不正确。 目的:本研究分析了食品和药物监督管理局(FDA)30个月内发布的药品...
-
阿里健康发公告 将向CFDA移交药检码
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论全国药品电子监管出现重大变动。2月21日,阿里健康就药品电子监管网后续运维方案发布公告称,阿里健康与国家食品药品监督管理局(CFDA)进一步讨论该事项,并成立一个联合工作组以讨论药品电子监管网的移交事项。 2月20日晚间,CFDA发布公告,明确暂停执行2015年1号...
-
药房状告CFDA 结果倒霉的是马云
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论近日,湖南养天和大药房企业集团有限公司状告中国食品药品监督管理局(CFDA)一事吵得沸沸扬扬:养天和就CFDA强制推行药品电子监管码一事向北京市第一中级人民法院提起行政诉讼。27日上午,CFDA召开座谈会,会上CFDA副局长孙咸泽表示,将收回此前交由阿里健康的全国药...
-
FDA审核首款“数字化药片” 小伙伴都惊呆了!
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论近年来,越来越多的初创公司已经将自己的目光放在了督促人们按照医嘱吃药这一科技“处女地”,因为诸如不按量吃药、服用过期药或者不按照规定间隔时间服药等行为已经令人们出现了不少的并发症,并浪费了医院和保险公司大量的财力、物力。据外媒近日报道,F...
-
律师广告会影响FDA措施与药物使用吗?
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论药品是特殊商品,对其广告宣传不仅受一般的消费品广告法规的约束,还要受特定的药品广告法和条例监控管理。2015年9月发表在《Drug Saf》的一项研究考察了律师广告对FDA措施、药物使用的影响。 介绍:律师赞助商电视广告包括对药品不良事件的重复警告,以请求消费者...
-
FDA新审批的药物与加速开发或评审项目数量的增加相关
环球医学资讯

 1小时条评论
1小时条评论2015年9月,发表于《BMJ》的一项队列研究考察了美国食品药品监督管理局(FDA)在过去20年间加快药物开发和审批项目的使用趋势。在过去的20年中,FDA新审批的药物与加速开发或评审项目数量的增加相关。但这一趋势被不是该类型第一个的药物所推动,因此创新性可能较少...
-
FDA批准一新药用于治疗晚期结直肠癌
环球医学资讯
 医学论坛网
医学论坛网 1小时条评论
1小时条评论近日,美国食品药品监督管理局(FDA)批准了Lonsurf用于对其他治疗无应答的晚期结直肠癌患者。 Lonsurf是一种口服药,用于治疗已经化疗和生物治疗的晚期(转移性)结直肠癌患者。 在一项随机双盲国际研究中,研究人员对Lonsurf的有效性和安全性进行了评...
-
重磅!全球首款女性“伟哥”获FDA批准
环球医学资讯
 生物谷
生物谷 1小时条评论
1小时条评论FDA近日批准了来自Sprout制药公司的一款备受争议的药物——“女性伟哥”Addyi(flibanserin,氟立班丝氨),该药是FDA批准的全球首款旨在提高女性性欲的药物。之前,FDA已连续2次拒绝Addyi,该药异常艰难的监管之路,已引发女性团体对FDA双重标...
-
CFDA重度科普:为什么要淘汰水银温度计和水银血压计?
环球医学资讯
 CFDA器械科
CFDA器械科 1小时条评论
1小时条评论“在国外,打碎温度计是件很严重的事,要上报医院管理委员会,委员会还要专门拨一笔钱来处理这个污染”。 “每次有人问体温计打碎了怎么办,我仍不知道该怎么回答。”北京师范大学环境历史学博士毛达说。他曾经是北京地球村的志愿者,这个...
-
FDA警告:2例服用芬戈莫德患者出现罕见脑部感染(PM…
环球医学资讯
 壹生
壹生 1小时条评论
1小时条评论FDA警告2例患者在服用治疗多发性硬化症(MS)的药物芬戈莫德(商品名Gilenya)后出现了进行性多灶性白质脑病(PML):1例已经明确诊断,1例为疑似病例。 FDA指出,这两例病例中,患者均未服用其他免疫治疗药物。2013年曾报道过1例出现PML的患者,但不能确定与服用芬戈莫德...
-
【重磅】FDA批准首个3D打印药品levetiracetam
环球医学资讯
 医学论坛网
医学论坛网 1小时条评论
1小时条评论8月3日,美国食品和药品监督管理局(FDA)批准了首个3D打印技术制造的口服药物——Spritam (levetiracetam),由Aprecia制药公司生产。 Levetiracetam作为部分癫痫发作、肌阵挛性发作的辅助治疗,以及成人全身强直阵挛性癫痫与儿童癫痫的治疗。 Spritam(levet...
-
国务院点名CFDA:整改药品审评!
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论国务院办公厅近日发出《关于对全国第二次大督查发现问题进行整改的通知》,要求整改26项事项。国家食品药品监督管理局成为被点名的9个国家部门之一,重点问题在于药品审评审批积压。由于该通知成文时间在7月20日,业内广泛认为7月22日在药圈引起震动的药物临床试验数...
-
FDA警告软组织填充剂无意注入面部血管可致严重不良…
环球医学资讯
 中国医学论坛报今日口腔
中国医学论坛报今日口腔 1小时条评论
1小时条评论2015年5月28日,美国食品与药物监督管理局(FDA)发布安全信息称,软组织填充剂无意注射入面部血管后,可引起注射部位血管阻塞及组织缺血,并可经血循环到达身体其他部位引发栓塞,导致视力障碍、失明、卒中及皮肤和面部深层结构的损伤和(或)坏死。 注射部位血管栓塞...
-
FDA警告软组织填充剂无意注入面部血管可致严重不良…
环球医学资讯
 中国医学论坛报今日口腔
中国医学论坛报今日口腔 1小时条评论
1小时条评论2015年5月28日,美国食品与药物监督管理局(FDA)发布安全信息称,软组织填充剂无意注射入面部血管后,可引起注射部位血管阻塞及组织缺血,并可经血循环到达身体其他部位引发栓塞,导致视力障碍、失明、卒中及皮肤和面部深层结构的损伤和(或)坏死。 注射部位血管栓塞报...
-
CFDA辟谣:未接到取消执业药师通知
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论近日,有微信公众号转发了人社部即将取消第四批职业资格的消息,并提示执业药师基本确定位列取消名单之中,霎时间医药界可谓人心惶惶。那么,执业药师真的要取消了吗?7月13日晚,国家食品药品监督管理总局执业药师资格认证中心(以下简称国家执业药师认证中心)在其...
-
FDA不予批复的新药批文与厂商发表的相关声明信息一…
环球医学资讯

 1小时条评论
1小时条评论FDA不予批复的新药批文与厂商发表的相关声明信息一致吗?2015年6月,发表于《BMJ》的一篇文章就两者的内容进行了对比。结果发现,FDA通常给厂商发布多个实质性原因的完整批复,最常见的是有关安全性和/或缺乏有效性。在许多情况下,厂商发布的内容没有回答这些内容,...
-
CFDA医疗器械监管司司长童敏被调查
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论5月29日上午10点25分,中央纪委监察部网站发布消息称:据驻国家食品药品监督管理总局纪检组监察局消息,国家食品药品监督管理总局医疗器械监管司司长童敏涉嫌严重违纪,目前正接受组织调查。随后,CFDA官网也确认了此消息。 现年52岁的童敏是江西南昌人,大学毕业后...
-
FDA批准的二代抗抑郁药的有效性试验中存在许多报道…
环球医学资讯
 环球医学编译
环球医学编译 1小时条评论
1小时条评论2015年5月,发表于《JAMA Psychiatry》的一篇文章调查药物治疗焦虑障碍的双盲安慰剂对照试验中检测报道的偏倚风险,并且对药物疗效夸大到何种程度进行量化。结果显示,FDA批准的治疗焦虑障碍的二代抗抑郁药的有效性试验中存在许多报道偏倚风险。 重要性:研究已经...
-
FDA发现的科研不端行为很少在同行评审文献中得到反映
环球医学资讯

 1小时条评论
1小时条评论人类对科研界的贡献瞩目,但是也有一些学术不端问题值得引起注。2015年4月,发表于《JAMA Intern Med.》的一篇文章介绍了一项考察了现实中对学术不端行为的关注和处理情况。结果现实当FDA发现偏离了良好临床实践时,这些问题很少在同行评审文献中有所反映,甚至在有...
-
CFDA药审中心副主任尹红章被“带走”
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论据媒体披露,58岁的国家食品药品监督管理总局药品审评中心(以下简称“药审中心”)副主任尹红章近日被检察机关带走调查。截至5月1日,国家食药总局仍未对外发布这一消息。据悉,尹红章是在4月27日一次药审中心的主任会议上被带走的。会议开的时间很长,甚...
-
FDA要求召回德国一款左心耳封堵器
环球医学资讯
 医学论坛网
医学论坛网 1小时条评论
1小时条评论美国食品与药物管理局(FDA)最近召回了一批TigerPawⅡ型(Maquet,Rastatt,德国)左心耳(LAA)封堵器,此次召回命令为FDA 1级(最高等级)。 有报告指出,此类型LAA封堵器或导致左心房壁撕裂及出血。这之后FDA于4月23日发布了召回命令,并表示上述不良预后或因封堵器紧固...
-
CFDA要求药企召回3万余支问题批次生脉注射液
环球医学资讯
 医学论坛网
医学论坛网 1小时条评论
1小时条评论4月24日,国家食品药品监督管理总局(CFDA)发布了关于江苏苏中药业集团股份有限公司生脉注射液质量问题的通告。以下为通告全文内容: 近日,江苏苏中药业集团股份有限公司生产的生脉注射液在广东省发生不良事件,个别患者用药后出现寒战、发热症状。经广东省食品药品...
-
FDA更新HCV抗病毒药Simeprevir用药说明
环球医学资讯
 医学论坛网
医学论坛网 1小时条评论
1小时条评论美国食品和药物管理局(FDA)更新了治疗丙型肝炎(HCV)抗病毒药Simeprevir用药说明,以提醒医生和患者,simeprevir联合胺碘酮和抗病毒药物sofosbuvir用药会增加严重症状性心动过缓以及肝衰竭和肝功能衰竭的患病风险。 今年3月,制药商报道了9例在服用胺碘酮和其他抗病毒...
-
FDA被“较真”的日本公司告上法庭
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论FDA是美国生物医药领域负责审批药物临床研究和上市事宜的最高机构,在众多生物医药公司看来,可谓是执掌了生杀大权。不过,日本人最近把FDA告上了法庭。消息显示,日本Otsuka Pharmaceuticals公司最近在美国联邦地方法院起诉FDA滥用监管权,损害了旗下Abilify的市场...
-
美FDA警告免疫抑制和抗癌药的乙肝激活:冰山一角
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论美FDA最近警告,所有进行化疗、免疫抑制治疗、造血干细胞移植或实体器官移植的患者,应筛查活性或既往乙型肝炎病毒感染。相关文章2015年2月发表在了《Hepatology》上。 在免疫抑制剂治疗中乙型肝炎病毒复活严重且存在潜在致命性。美国食品和药物管理局最近对接受抗CD...
-
FDA批准新的院外心肺复苏系统
环球医学资讯
 医脉通
医脉通 1小时条评论
1小时条评论近日,FDA批准了一种新的院外心肺复苏系统,该系统可用于非创伤性心脏骤停成人患者。 ResQCPR系统由两个设备组成,可由第一响应者使用。第一个设备(ResQPump Active Compression Decompression CPR Device)是有两个把手的吸盘,救援者可用其对患者胸部进行按压与减...
-
FDA批准帕金森症长效疗法上市
环球医学资讯
 生物探索
生物探索 1小时条评论
1小时条评论随着老年化社会的进程,医药企业都越来越重视如帕金森症、阿尔兹海默症等神经退行性疾病的研究。然而,限于目前医学界对这类疾病认识水平,这类药物也一直是医药产业界的重灾区。不过,最近艾伯维宣布公司开发的用于治疗晚期帕金森症患者运动波动的药物DUOPA获得FDA...
-
FDA再次警告远离“超声波留影拍照”
环球医学资讯
 生物探索
生物探索 1小时条评论
1小时条评论对腹中胎儿作超声波检查,可以看到胎儿面部表情和肢体动作。因此,一些准父母乐此不疲地对尚未出生的宝宝“现场直播”,希望以此加强与宝宝的情感交流。家用超声波扫描仪也在欧美国家一直很畅销也逐渐风靡中国。 但是,近日FDA再次重申“孕育健康宝宝...
-
FDA关于非甾体抗炎药心血管风险的建议
环球医学资讯

 1小时条评论
1小时条评论2014年11月,发表于《Drug Saf》的一篇文章介绍了FDA近期对于NSAIDs相关心血管风险的建议。 2014年2月,美国食品和药物管理局(FDA)召开了一次顾问委员会会议来讨论越来越多的与非甾体抗炎药(NSAIDs)的心血管风险相关的数据,及其对处方标签类别的潜在影响。委员...
-
震惊!FDA批准的抗癌新药74%没用
环球医学资讯
 美中药源
美中药源 1小时条评论
1小时条评论近日,美国密尔沃基一本叫做《Sentinel and MedPage Today》的杂志发表一篇文章分析过去10年FDA批准上市的抗癌药,结果发现在54个上市新药中有74%的药物没有证据显示能延长患者寿命,也不能改善患者生活质量。 在2004-2011年上市的26个新药中只有3个显示能延长患者寿...
-
FDA:保留戒烟药伐尼克兰黑框警告
环球医学资讯
 医学论坛网
医学论坛网 1小时条评论
1小时条评论FDA专家委员会在评估更新资料之后,推荐保留戒烟药伐尼克兰(varenicline)黑框警告。 自2006年获批用于辅助戒烟,varenicline即与自杀念头和行为以及攻击/无理行为等严重神经心理学事件具有相关性。FDA因而于2009年设置黑框警示强调上述风险。 观察性研究和生产商辉瑞...
-
触发式报告:FDA不良事件报告系统的预警是否得到响…
环球医学资讯

 1小时条评论
1小时条评论美国食品和药物管理局(FDA)使用不良事件报告系统(FAERS)来支持上市后安全性监测计划。但不良事件(AE)“触发报告”的响应是否与美国FDA发出警告、警报和标签的变化协同呢? 2014年6月,发表在《Drug Saf.》上的的一项研究显示,现代FAERS报告没有明显...
-
FDA批准布地奈德治疗溃疡性结肠炎
环球医学资讯
 医脉通
医脉通 1小时条评论
1小时条评论根据一份公司的新闻稿,FDA已经授予布地奈德直肠泡沫在轻度至中度活动性远端溃疡性结肠炎患者中用于缓解诱导的最终批准。 新闻稿中指出,布地奈德(Uceris,Salix Pharmaceuticals)2mg皮质类固醇,直肠给药,可以更好的将活性药物分不到末端结肠,不像当前已批准的...
-
盘点:2014年FDA批准的孤儿药
环球医学资讯
 咸达数据
咸达数据 1小时条评论
1小时条评论1982年,美国的罕见病家庭和支持团体成立了一个“非正式联盟”,呼吁立法支持孤儿药和治疗罕见病的药物研发,1983年,这个组织成功使美国国会通过了“孤儿药法案”,该法案制定了发展孤儿药的诸多激励性措施。30多年过去了,FDA共认证近3000个孤...
-
FDA批准Keytruda治疗晚期黑色素瘤
环球医学资讯
 中国科学报
中国科学报 1小时条评论
1小时条评论近日,美国食品药品监督管理局(FDA)通过加速批准程序批准了美国默克公司Keytruda (pembrolizumab)成为首例获批的PD-1(程序性死亡受体1)单抗。该药用于治疗不再对其他药物响应的晚期或无法切除的黑色素瘤。 Pembrolizumab是一种新型人源化单抗,通过作用于PD-1来提升...
-
CFDA要求修订盐酸曲美他嗪说明书
环球医学资讯
 国家食品药品监督管理总局
国家食品药品监督管理总局 1小时条评论
1小时条评论为适应科学用药需要,保障公众用药安全,国家食品药品监督管理总局(CFDA)近日决定对盐酸曲美他嗪片及盐酸曲美他嗪胶囊说明书进行修订,修订内容涉及【适应证】、【用法用量】、【不良反应】、【禁忌】、【注意事项】、【孕妇及哺乳期妇女用药】、【儿童用药】、【...
-
FDA批准olodaterol治疗慢阻肺
环球医学资讯
 中国科学报
中国科学报 1小时条评论
1小时条评论近日,美国食品药品监督管理局(FDA)批准了德国勃林格殷格勒旗下新药Striverdi Respimat(olodaterol)吸入气雾剂用于慢性阻塞性肺病(COPD)的治疗。COPD是一种严重的肺疾病,随时间推移而发生恶化,其症状包括气喘、咳嗽、胸闷和气短。吸烟是COPD的主要因素。 Striverdi...
-
CFDA:关注曲美他嗪引起运动障碍等安全性风险
环球医学资讯
 CFDA官网
CFDA官网 1小时条评论
1小时条评论曲美他嗪于2000年在我国上市,目前有片剂(20 mg)和缓释片剂(35 mg)两种剂型。曲美他嗪属于心血管系统药物,临床用于心绞痛发作的预防性治疗和眩晕、耳鸣的辅助性对症治疗。近期,欧盟药品管理局(EMA)发布消息,建议限制曲美他嗪的使用,并警惕其引起的运动功能...
-
FDA不批准孟鲁斯特转为非处方药
环球医学资讯

 1小时条评论
1小时条评论2014年6月,发表于《Lancet Respir Med》的一篇文章指出,日前,美国食品药品监督管理局(FDA)非处方药咨询委员会拒绝了默克将孟鲁斯特(Singulair)转为治疗过敏性鼻炎的非处方药的申请。 该药目前是用于治疗儿童和成人过敏性鼻炎、哮喘,和运动诱发支气管痉挛的处...
-
FDA:批准Sivextro治疗成人皮肤感染
环球医学资讯
 医学论坛网
医学论坛网 1小时条评论
1小时条评论《期刊观察》(Journal Watch)2014年6月23日新闻。 一种新型抗细菌药,tedizolid(商品名Sivextro)已经获得美国食品与药物管理局(FDA)批准,用于治疗成人急性细菌性皮肤和皮肤组织感染,包括耐甲氧西林金黄色葡萄球菌、链球菌和肠球菌。Tedizolid现有静脉注射和口服两...
-
药物是如何被FDA研发和审批的:当前进展和未来方向
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论2014年5月,在线发表在《Am J Gastroenterol》的一项研究对FDA药物研发和审批监管过程、药物研发相关成本评估进行概述,同时也研究了FDA在未来面临的问题和挑战。 目的:本文对FDA药物研发和审批监管过程进行概述,对药物研发相关成本的评估进行概述,另外也研究了FD...
-
FDA批准阿必鲁泰治疗2型糖尿病
环球医学资讯
 丁香园
丁香园 1小时条评论
1小时条评论4月15日,美国FDA批准阿必鲁泰(Albiglutide;商品名Tanzeum)皮下注射剂结合饮食与运动用于改善2型糖尿病成人患者的血糖控制。在美国,大约有2400万人受2型糖尿病影响,占美国确诊糖尿病病例的90%以上。随着时间的推移,高血糖水平会增加严重并发症风险,包括心脏病、...
-
SOT供者使用利妥昔单抗应遵循FDA关于HBV病毒再激活…
环球医学资讯
 环球医学编写
环球医学编写 1小时条评论
1小时条评论2014年4月,在线发表在《Am J Transplant》的一项研究对利妥昔单抗在SOT人群中的应用进行综述。建议使用利妥昔单抗的SOT供者应该遵循FDA关于HBV病毒再激活的警告和建议。 利妥昔单抗,一种特异与CD20抗原结合的嵌合单克隆抗体,仍然以标识外使用的方式在实体器官移植...
-
FDA扩美敦力CRT适应证
环球医学资讯
 医学论坛网
医学论坛网 1小时条评论
1小时条评论近日,美国食品与药物管理局(FDA)批准了10种美敦力双心室起搏器用于治疗伴有不太严重收缩期心衰和需右室置入起搏器的房室传导阻滞患者。 CRT-D和CRT-P既往仅被批准用于LVEF<35%且QRS间期延长的心衰患者。此次适应证扩展主要基于BLOCK-HF随机试验结果而做出。BLOCK-HF...
-
2013年美国FDA和EMA抗肿瘤新药审批情况回顾
环球医学资讯
 中国医学论坛报
中国医学论坛报 1小时条评论
1小时条评论2013年美国食品与药品管理局(FDA)和欧洲药品管理局(EMA)均批准了十余种抗肿瘤新药。两个机构尤其是美国FDA在药品审批路径方面有很多可借鉴的工作模式。以下,笔者对2013年美国FDA和EMA抗肿瘤新药的审批情况做一回顾总结。 2013 年FDA 抗肿瘤新药审批情况 2013年美国F...
-
FDA支持批准吸入型糖尿病药Afrezza
环球医学资讯
 丁香园
丁香园 1小时条评论
1小时条评论4月1日,美国FDA顾问小组推荐批准MannKind公司的吸入型糖尿病药物Afrezza,称这款药物可能会帮助患者,特别是那些对胰岛素注射针头有恐惧心理的患者。FDA顾问小组表示,虽然Afrezza对1型糖尿病成人患者没有表现出收益,但它对更常见的2型糖尿病却是明显安全有效的。 ...
-
FDA建议罗氏HPV试剂盒用于一线初筛宫颈癌
环球医学资讯

 1小时0条评论
1小时0条评论罗氏(Roche)3月13日宣布,FDA医疗器械顾问委员会微生物学设备专家小组一致投票建议批准该公司研发的人类乳头瘤病毒(HPV)试剂盒cobas HPV Test作为一种一线、初级筛查工具,用于25岁及以上女性宫颈癌的初级筛查。该试剂盒是基于临床相关高风险HPV DNA的存在来评估...
-
FDA更改多尼培南标签
环球医学资讯
 医学界网站
医学界网站 1小时0条评论
1小时0条评论美国食品药品监督管理局(FDA)已经批准对于抗生素药物多尼培南(Doribax, 强生公司)标签的更改,用于警示该药物增加了呼吸机相关肺炎患者死亡的风险。 某经销商在其网站“今日安全声明”板块中写道:“在对使用抗生素药物患者人群研究中,同注射亚...
-
FDA准曲美替尼+达拉非尼治晚期黑色素瘤
环球医学资讯
 中国医学论坛报
中国医学论坛报 1小时0条评论
1小时0条评论2014 年 1 月 10 日 FDA 通 过 加 速 程 序 批准曲美替尼 trametinib 联 合 达 拉 非 尼 dabrafenib 用于治疗不可切除或转移性晚期 黑 色 素 瘤 。 因 为 两 药 联 合 治 疗 严 重 疾 病 具 有 明 显 的 安 全 性 和 有 效 性 潜 力 ,FDA 给 予 其优先复审权。 曲 ...
-
JAMA:FDA更新波普瑞韦禁忌症
环球医学资讯
 丁香园
丁香园 1小时0条评论
1小时0条评论美国食品药品监督管理局(FDA)于近日更新了波普瑞韦(boceprevir)药物标签,表明波普瑞韦与钙通道阻滞剂、α1-肾上腺素受体拮抗剂相互作用可能有害。 2011年5月,FDA批准蛋白酶抑制剂波普瑞韦用于丙肝的治疗。2012年4月,FDA发出警告,对于HCV和HIV合并感染的...
-
FDA批准治房颤新型导管
环球医学资讯
 丁香园
丁香园 1小时0条评论
1小时0条评论日前,FDA批准Thermocool Smarttouch消融导管用于耐药的阵发性房颤(AF)患者,持续性单型缺血性室性心动过速及I型心房扑动患者。这款器械由强生下属公司Biosense Webster生产。据公司介绍,这款器械“是美国获批的首个治疗导管,它能在导管消融期间直接并实时检...
-
FDA第三次拒绝批准利伐沙班ACS适应证
环球医学资讯
 医脉通
医脉通 1小时0条评论
1小时0条评论2月14日,美国食品和药品管理局(FDA)再次拒绝批准新型口服抗凝药利伐沙班的两项新适应证——用于预防急性冠脉综合征(ACS)患者新的心肌梗死、卒中及死亡以及用于预防心脏支架内血栓形成。这是FDA第三次拒绝利伐沙班用于ACS的申请。FDA认为利伐沙班应与...
-
CFDA公布创新医疗器械特别审批程序文件
环球医学资讯
 环球医学编写
环球医学编写 1小时0条评论
1小时0条评论2月7日,国家食品药品监督管理总局(CFDA)公布了《创新医疗器械特别审批程序(试行)》,旨在保障医疗器械的安全、有效,鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用,推动医疗器械产业发展。文件全文如下: 创新医疗器械特别审批程序(试行) 第一...
-
FDA审查沙格列汀心衰风险
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论2月11日,美国食品与药物管理局(FDA)宣布称正在要求沙格列汀(saxagliptin)的厂商提交相关临床数据,以审查2型糖尿病患者应用该药治疗的可能心力衰竭风险。FDA相关人士希望在3月底能收到该药所有的临床数据并尽快完成审查将其结果公诸于众。 发表于《新英格兰医学杂志...
-
FDA批准结肠检查新方法
环球医学资讯
 丁香园
丁香园 1小时0条评论
1小时0条评论结直肠息肉、癌变等至今仍然依赖于结肠镜检查的金标准,但是结肠镜的检查往往令患者望而生畏,异常的疼痛不适,甚至使得很多患者放弃检查。 日前,由Given Imaging公司设计开发的可吞服式胶囊相机获得FDA的批准,用于帮助发现息肉等结肠癌早期表现。Given Imaging是...
-
CFDA:警惕头孢唑林注射剂严重不良反应
环球医学资讯

 1小时0条评论
1小时0条评论日前,国家食品药品监督管理总局发布了第59期药品不良反应信息通报 ,本期通报为《警惕头孢唑林注射剂严重不良反应》。头孢唑林为第一代头孢菌素,在合理使用情况下,总体安全性较好,其不良反应表现与其他头孢菌素类抗生素相似,无特殊性。但由于头孢唑林注射剂在基...
-
FDA批准曲美替尼-达拉菲尼联合治疗黑色素瘤
环球医学资讯
 医脉通
医脉通 1小时0条评论
1小时0条评论2014年1月10日美国FDA宣布批准MEK抑制剂曲美替尼和BRAF抑制剂达拉菲尼联合治疗BRAF V600E或V600K突变的不可手术或转移性黑色素瘤。 FDA批准此两款药联合治疗黑色素瘤是基于一项开放的I/II研究,结果显示:与达拉菲尼单药治疗相比,曲美替尼和达拉菲尼联合治疗能够有...
-
FDA限对乙酰氨基酚治感冒
环球医学资讯
 广州日报
广州日报 1小时0条评论
1小时0条评论价廉物美感冒药也不得安生,近期先是被传可提取感冒药中的麻黄碱用来制冰毒,接着美国食品与药物管理局近日发公告称,将限制医生对含有对乙酰氨基酚成分感冒药的使用。本报记者昨日走访广州多家药店发现,目前我国市面上的感冒药中普遍添加了对乙酰氨基酚,而多数消...
-
谷歌与FDA会面 生物传感医疗项目呼之欲出
环球医学资讯
 网易科技
网易科技 1小时0条评论
1小时0条评论据国外媒体报道,日前多位与谷歌X研究小组有关联的谷歌员工与负责美国医药设备审查的监管部门进行了会面,这家曾经研发出谷歌眼镜、无人驾驶汽车的神秘部门很可能正在研发一款和生物传感器有关的新产品。 据称至少有四位谷歌员工参与了这次会面,其中一些与谷歌神秘...
-
FDA再次对利伐沙班用于ACS强硬的说“NO”
环球医学资讯
 环球医学编写
环球医学编写 1小时0条评论
1小时0条评论日前,美国食品和药物监督管理局(FDA)在对缺少数据、亚组分析、统计上的稳健性进行了多轮的讨论后,再次拒绝了新型抗凝剂利伐沙班用于急性冠脉综合症(ACS)的申请。 FDA顾问委员会小组中的成员对此进行了投票,,小组成员的选择几乎一致,投票的结果为10:0,其中...
-
FDA顾问小组推荐批准新的抗凝药Vorapaxar
环球医学资讯
 环球医学编写
环球医学编写 1小时0条评论
1小时0条评论美国食品和药物管理局(Food and Drug Administration,FDA)顾问委员会以压倒性票数支持批准Vorapaxar。这是一种新型蛋白酶激活受体1(PAR-1)拮抗剂,旨在抑制凝血酶诱导的血小板激活,用于MI后的治疗。 心血管和肾脏药物顾问委员会以10:1的投票结果支持批准用于MI...
-
FDA建议批准vorapaxar治疗既往MI患者
环球医学资讯
 医脉通
医脉通 1小时0条评论
1小时0条评论近日,FDA心血管和肾脏药物顾问委员会(CRDAC)以10比1的投票结果,建议批准抗血小板药物vorapaxar用于有心肌梗死(MI)史患者的辅助治疗。如果获批,vorapaxar将以商品名Zontivity上市,作为标准疗法的辅助药物,以减少心血管死亡、心肌梗死、卒中和紧急冠状动脉血...
-
FDA批准雷特格韦的婴儿用新配方
环球医学资讯
 环球医学编写
环球医学编写 1小时0条评论
1小时0条评论近日,美国食品和药物管理局(Food and Drug Administration,FDA)已经批准HIV药物雷特格韦(Raltegravir)作为儿科口服混悬剂。此口服混悬剂或可用于4周大的患者,体重为3kg~20kg。 雷特格韦如今是HIV-1感染婴儿和4周大幼儿治疗计划的一部分,属于HIV整合酶链转移...
-
FDA批准糖尿病新药Farxiga
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论美国食品与药品管理局(FDA)1月8日批准糖尿病新药Farxiga结合饮食和锻炼,用于改善2型糖尿病患者的血糖控制。 Farxiga是钠-葡萄糖协同转运蛋白2(SGLT2)抑制剂的新型药物,也是继Invokana去年3月通过核可后,FDA批准的第2种同类型药物。 Farxiga最常见的副作用是真菌...
-
FDA招募达比加群研究
环球医学资讯
 环球医学编写
环球医学编写 1小时0条评论
1小时0条评论近日,美国FDA正在为其建议的一项研究向社会公开招募研究资金。该研究旨在对近期使用达比加群或华法林治疗的成年心房颤动患者进行安全性及治疗结局的评估。该安全性评估将特别关注与使用华法林治疗的患者相比,使用达比加群患者缺血性卒中、颅内出血及严重颅外出血的...
-
FDA新政力图打击微生物耐药性问题
环球医学资讯
 生物
生物 1小时0条评论
1小时0条评论FDA希望药品公司可以改变标签,农民需要兽医批准才可以给动物使用抗生素。 微生物耐药性问题日益严重的情况可归因于多个因素,但公共卫生倡导者经常将矛头指向农业。农场管理者使用了美国超过 70% 的抗生素,以改善和促进畜禽的生长。12 月 11 日,美国食品药品监督...
-
FDA警告:氯巴占可致严重皮肤反应
环球医学资讯
 环球医学编写
环球医学编写 1小时0条评论
1小时0条评论美国当地时间12月3日,美国食品和药物管理局(FDA)宣布,抗癫痫药物氯巴占(Clobazam)可能诱发罕见但可致命的皮肤反应,包括Stevens-Johnson综合征(SJS)和中毒性表皮坏死松解症(TEN),这些反应可能对患者产生严重的伤害甚至死亡。 氯巴占是苯二氮卓类药物, 20...
-
FDA:警惕氯巴占致严重皮肤反应
环球医学资讯

 1小时0条评论
1小时0条评论2013年12月3日,美国食品与药物管理局(FDA)发布药物安全通告,提醒公众抗癫痫药氯巴占(clobazam)可能导致罕见但严重的皮肤反应,包括Stevens-Johnson综合征(SJS)和中毒性表皮坏死松解症(TEN),这一反应可能对患者产生久性伤害或死亡。该反应可在接受氯巴占治...
-
FDA:警惕瑞加德松和腺苷致严重不良事件
环球医学资讯

 1小时0条评论
1小时0条评论2013年11月20日,美国食品与药物管理局(FDA)提醒医疗工作人员,心脏核素负荷试验所应用的药物瑞加德松(regadenoson)和腺苷(adenosine)可能导致罕见但严重的心脏病发作和死亡危险。FDA已批准上述药物标签添加这些严重事件的更改,并更新了药物应用的推荐建议。F...
-
FDA批准首个预防H5N1禽流感的佐剂疫苗
环球医学资讯

 1小时0条评论
1小时0条评论2013年11月22日,美国食品与药物管理局(FDA)批准了首个用于预防H5N1禽流感的佐剂疫苗上市,该疫苗适用于H5N1流感病毒暴露风险增加的年龄≥18岁的人群。 在临床试验中,接种H5N1禽流感的佐剂疫苗患者最常见的副作用为注射部位疼痛, 还有肌肉疼痛、头痛、疲乏、注...
-
FDA监管对儿童局部钙调磷酸酶抑制剂标识外一线应用…
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论11月在《Pediatrics》上发表的一项研究对2005年美国FDA管制行为前后期间,局部钙调磷酸酶抑制剂(TCIs)中的他克莫司与吡美莫司在儿童适应证以外的用法进行了评估。结果表明,2005年FDA监管行动后,小于2岁的儿童使用TCI的比率大幅度下降。 目的:在2005年美国FDA规...
-
FDA不良事件报告系统报告的TNF-α抑制剂的神经系统…
环球医学资讯
 环球医学编写
环球医学编写 1小时0条评论
1小时0条评论2013年8月,在线发表在《消化药理学和治疗学》(Aliment Pharmacol Ther)的一项研究对肿瘤坏死因子-α(TNF-α)抑制剂和神经系统不良事件(AEs)的新发类型间的关系进行了研究。 背景:肿瘤坏死因子-α(TNF-α)抑制剂和新发神经系统不良事件...
-
面对移动医疗app,FDA是监管还是放任?
环球医学资讯

 1小时0条评论
1小时0条评论随着技术的推陈出新,移动医疗app的功用正在不断被扩展。为了保证医疗行业的发展,维护患者的健康利益,监管是合理的,是在所难免的。在一定程度上,监管已经发生了。而现有监管政策缺乏针对患者健康问题的明确说明,这的确让人担忧移动医疗app的发展。 移动医疗app...
-
FDA质疑GSK药物Anoro Ellipta安全性
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论葛兰素史克(GSK)在中国风波不断,而近日FDA对其旗下慢性阻塞性肺疾病(COPD)治疗药物Anoro Ellipta的审查也传来了不太乐观的消息。 葛兰素史克正在寻求Umeclidinium/ Vilanterol(商品名Anoro Ellipta)作为一款日用一次的支气管扩张药上市,用于COPD患者长期的气流...
-
FDA对高压氧治疗常见标签外使用发布警告
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论美国食品药品管理局(FDA)近日在其网站的消费者警告栏目中对高压氧治疗发布警告称,目前,尚无相关证据证明高压氧治疗(HBOT)在临床上对癌症、自闭症或糖尿病有治疗作用或对其有效。FDA报道,在过去三年内已收到27项投诉,称HBOT中心为没有获得FDA批准的病症提供HB...
-
FDA发布医疗器械射频无线技术指南
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论FDA近日发布题为《行业及食品药品管理局工作人员指南:医疗器械射频无线技术》的指南。该指南适用于植入式和携带式器械,以及其他预定用于医院、家居、诊所及临床实验室等地点的器械。该指南涵盖了无线医疗器械的设计、测试、配置和维护,以保证其安全可靠。 该指南...
-
FDA批准新型癫痫药物Trokendi XR
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论近日,美国食药监局(FDA)批准了一种新的癫痫治疗药物Trokendi XR,该药将于未来几周内上市。 该药是每日服用一次的新型缓释制剂托吡酯(Topiramate,先前称为SPN-538)。FDA表示已完成该药所有申请资料的审查,即日起将推荐TrokendiXR用做治疗各类癫痫发作。此...
-
FDA警示:氟喹诺酮类药物或可导致永久性周围神经病变
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论日前,美国食品和药物管理局(FDA)宣布,氟喹诺酮类抗菌药物口服或注射可能会导致永久性周围神经病变,该风险应在更新的药品标签上进行标注。 到目前为止,FDA共批准了6个氟喹诺酮类药物上市:吉米沙星、环丙沙星、左氧氟沙星、莫西沙星、诺氟沙星及氧氟沙星。2011...
-
巴西监管机构vs FDA对儿童抗癫痫处方药物未经许可和…
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论题目:儿童抗癫痫处方药物未经许可和标识外使用评估:巴西监管机构vs FDA(Evaluation of unlicensed and off-label antiepileptic drugs prescribed to children: Brazilian Regulatory Agency versus FDA) 背景:儿童癫痫发作多见于神经系统障碍;4%~10%不足16岁...
-
FDA批准Dolutegravir新药用于治疗HIV-1感染
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论日前,美国食品和药物管理局(FDA)批准了一种称为Dolutegravir的新药物作为辅助药物,协同其他抗逆转录病毒药物治疗HIV-1感染患者。 Dolutegravir为HIV整合酶抑制剂,干扰与艾滋病毒繁殖所需的有关酶,每日服用一次。 该药的适用人群包括未服用过HIV抗逆转录病毒治...
-
FDA发出盐酸甲氟喹“黑框警告”
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论近日,美国食品和药品管理局(FDA)通知公众注意最近更新的关于抗疟疾药物盐酸甲氟喹的“黑框警告”:服用该药,可能导致患者产生精神或者神经副作用。 据悉,FDA的“黑框警告”是提示服用药物潜在风险级别中最高的一种。
-
FDA警告含对乙酰氨基酚或致死亡性皮疹
环球医学资讯

 1小时0条评论
1小时0条评论美国食品药品管理局(FDA)近日在其官网上宣布,含有对乙酰氨基酚(退热净、扑热息痛)的止疼药有可能会引发严重皮疹,或致人死亡。常见品牌包括泰诺。从中国国家食药监总局网站查询,国内生产对乙酰氨基酚的批件信息共1323条,涉及多家上市公司。 FDA称,有可能致命...
-
FDA与EMA立场一致:支持肠促胰岛素不增加胰腺疾病风险
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论7月26日,欧洲药品管理局(EMA)表示,现有数据不能证实胰高血糖素样肽-1治疗会增加糖尿病患者胰腺疾病的风险。随后美国食品和药物管理局(FDA)发言人向医学界媒体表示同意这一说法。 EMA医药产品委员会(CHMP)指出,之前他们已经完成了对GLP-1治疗糖尿病的评估,...
-
FDA批准Gilotrif用于肺癌患者
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论圣路易斯(MD Consult)——2013年7月12日,美国食品药品管理局(FDA)宣布,已批准将Gilotrif(阿法替尼)用于治疗在伴随诊断检测(therascreen EGFR RGQ PCR试剂盒)中发现有表皮生长因子(EGFR)外显子19删除或外显子21 L858R取代基因突变的晚期(转移性)非小细胞...
-
FDA批准首个注意力缺陷多动障碍(ADHD)脑电波评估…
环球医学资讯

 1小时0条评论
1小时0条评论2013年7月15日,美国食品和药物管理局(FDA)批准首个基于脑部功能的医疗设备上市,以提高专家诊断儿童和青少年(6至17岁)注意力缺陷多动障碍(ADHD, attention-deficit/hyperactivity disorder)的准确性。 作为完整的医疗和心理检查的一部分,该设备可以提高ADHD...
-
FDA限制使用酮康唑口服片剂
环球医学资讯

 1小时0条评论
1小时0条评论7月26日,美国食品和药物管理局(FDA)对酮康唑(Nizoral)口服片剂采取了一系列的措施,包括公布了酮康唑(Nizoral)口服片剂的使用限制,警告其存在潜在的致命性肝损伤、药物间相互作用和肾上腺问题的风险,FDA对酮康唑口服药物进行了标签变更,并添加了新的药物使...
-
FDA重新接受糖尿病药物达格列净的新药申请
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论日前,美国食品和药物管理局(FDA)承认,重新接受糖尿病治疗药物达格列净的新药申请。该药物为钠-葡萄糖协同转运蛋白2 (SGLT-2)抑制剂,主要用来治疗2型糖尿病患者。该机构想要在2014年1月11日前发布一个新的处方药消费者付费法案,因此需要在该时间之前对达格列...
-
FDA批准可同时检测结核菌和抗生素耐药性的快速检验
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论日前,美国食品药品管理局(FDA)批准首个可发现结核病细菌以及是否对利福平抵抗的检测。 如果没有大的异常,这个检测在2小时内就可以同时回答检测结核及抗生素耐药性问题。据FDA,传统的方法鉴定抗生素耐药结核病则需要1~3个月。 该机构在新闻稿中表示,称为Xpert ...
-
来那度胺治疗慢性淋巴细胞性白血病临床试验惨遭FDA…
环球医学资讯
 环球医学编写
环球医学编写 1小时0条评论
1小时0条评论近期,美国食品药品管理局(FDA)宣布暂停抗肿瘤药物来那度胺的临床试验,该临床试验的安全性有待考量。 来那度胺是一种口服免疫调节药物,能够抑制肿瘤细胞的生长,对免疫系统和肿瘤细胞微环境有多种影响。此药物于2006年获美国FDA 批准上市,主要用于骨髓增生异常...
-
FDA批准戈利木单抗用于类风湿性关节炎
环球医学资讯

 1小时0条评论
1小时0条评论7月18日,美国食品药品管理局(FDA)宣布,已批准戈利木单抗(golimumab)输液剂联合甲氨蝶呤用于治疗中至重度活动性类风湿性关节炎(RA)成人患者。 该批准令为这一RA药物增加了新的适应证。最初,FDA于2009年批准每月1次皮下注射戈利木单抗用于治疗中至重度活动性RA、活...
-
FDA批准阿法替尼治疗晚期肺癌患者
环球医学资讯

 1小时0条评论
1小时0条评论2013年7月12日,美国食品和药物管理局(FDA)批准阿法替尼(Gilotrif)用于治疗表皮生长因子受体(EGFR)基因突变的转移性非小细胞肺癌(NSCLC)。 肺癌是癌症相关死亡的首要因素,根据美国国家癌症研究所数据显示,2013年预计228190名美国人将会确诊为肺癌,其中预计有...
-
新一代可吸收抗菌包膜获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论7月9日,美国TYRX公司宣布,新一代的可吸收AIGISRx R可吸收抗菌包膜已获得FDA的批准。AIGISRx系列抗菌包膜用于封装心脏起搏器和植入式心脏除颤器等设备,预防心脏植入装置(CIED)引致的感染。R代表AIGISRx中可吸收的型号。 随着植入CIED的病人不断增多,CIED感染的...
-
FDA批准艾斯能贴剂治疗重度阿尔茨海默病
环球医学资讯
 环球医学编写
环球医学编写 1小时0条评论
1小时0条评论2013年6月27日,美国食品药品管理局(FDA)扩大了艾斯能贴剂(卡巴拉汀经皮治疗系统)的适应证,将治疗重度阿尔茨海默病(AD)纳入其中。去年9月,该药获得了治疗轻至中度阿尔茨海默病的批准。 艾斯能贴剂是目前唯一获准用于所有阶段AD患者的经皮治疗产品。此次批准...
-
FDA发布奥美沙坦使用警告
环球医学资讯
 环球医学编写
环球医学编写 1小时0条评论
1小时0条评论7月3日,美国食品和药物管理局(FDA)发出警告,降压药物奥美沙坦会导致类似口炎性腹泻的严重肠病。就上述不良反应内容,FDA已经批准更改这些药物的标签。 奥美沙坦是一种血管紧张素Ⅱ受体阻断剂(ARB),被批准用于高血压的单独治疗或与其他降压药联合使用,是8个上...
-
FDA批准奥美沙坦标签变更
环球医学资讯

 1小时0条评论
1小时0条评论7月3日,美国食品和药物管理局(FDA)发出警告,降压药物奥美沙坦(包括Benicar, Benicar HCT, Azor, Tribenzor及仿制药)会导致类似口炎性腹泻的严重肠病(sprue-like enteropathy)。FDA已经批准就上述不良反应内容更改这些药物的标签。 类似口炎性腹泻样肠道疾病...
-
FDA拒绝利伐沙班用于预防支架内血栓形成
环球医学资讯
 环球医学编写
环球医学编写 1小时0条评论
1小时0条评论近日,美国食品药品管理局(FDA)表示,暂不批准抗凝剂利伐沙班用于降低急性冠状动脉综合征(ACS)患者支架内血栓形成的风险。 自2011年利伐沙班获准用于预防膝关节或髋关节置换术患者深静脉血栓形成(DVT)以及降低非瓣膜性房颤患者的卒中和全身性栓塞风险以来,FDA...
-
FDA更新达沙替尼治疗慢性粒细胞白血病的标签
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论美国食品和药物管理局(FDA)已批准2个达沙替尼药物关于适应症,疗效和安全性更新信息的变更。 已更新的标签包括对新诊断的费城(PH)染色体阳性慢性粒细胞白血病(CML)慢性期患者的3年疗效和安全性数据。该适应症于2010年授权了加速批准,需要更新标签。 新的标签...
-
对所有人免疫球蛋白制品 FDA要求添加血栓形成风险黑…
环球医学资讯

 1小时0条评论
1小时0条评论美国食品与药物管理局(FDA)基于对数据和血栓形成不良事件报告的回顾性分析,对人免疫球蛋白制造商提出以下要求:在所有静脉注射用人免疫球蛋白标签的现有黑框警告中,添加血栓形成信息;在所有皮下和肌肉注射用人免疫球蛋白的标签中,添加黑框警告,突出血栓形成风...
-
FDA警告:羟乙基淀粉溶液的死亡率风险较高
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论近日,美国食品和药物管理局(FDA)宣布,临床医生不应该对危重患者使用羟乙基淀粉(HES)解决方案,包括败血症和那些住进重症监护病房中的危重病人。 这些指令是从FDA关于在这些危重病人的肾功能损伤和死亡率的研究中得出的,并将出现在药物标签上的黑框警告中。此...
-
FDA审查奥氮平治疗后死亡的两例病例
环球医学资讯

 1小时0条评论
1小时0条评论2013年6月18日,美国食品与药物管理局(FDA)发布通告称其正在审查两例死亡病例,这两例患者在接受适宜剂量的抗精神病药奥氮平双羟萘酸盐肌肉注射剂(Zyprexa Relprevv,礼来公司)治疗的3—4天后死亡,且两例患者在死亡后体内血液奥氮平水平很高。应用大剂量的...
-
FDA批准HCV基因型检测试剂盒上市
环球医学资讯

 1小时0条评论
1小时0条评论2013年6月20日,美国食品与药物管理局(FDA)批准了可检测到患者携带的丙型肝炎病毒(HCV)基因型的试剂盒(Abbott RealTime HCV Genotype II)上市,该试剂盒可对感染者的血清或血浆标本鉴别出基因型1、1a、1b、2、3、4和5。 该检测方法获准用于已知的HCV慢性感染者...
-
FDA批准HCV患者基因分型检测
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论为了让医生更好地制定最合适的治疗选择,美国食品和药物管理局(FDA)今日批准了丙型肝炎病毒(HCV)患者的基因分型检测。 HCV基因型II检测利用感染患者血液中的血浆或血清样品,可以区分HCV基因型1、1a、1b、2、3、4和5。由于不同丙型肝炎病毒基因型对现有可用药物...
-
FDA关于大剂量西酞普兰警告受质疑
环球医学资讯

 1小时0条评论
1小时0条评论美国一项研究对美国食品与药物管理局(FDA)“西酞普兰>40 mg/d可能导致心律失常”的警告提出质疑。研究表明,与(1~20) mg/d相比,西酞普兰>40 mg/d与室性心律失常(校正HR=0.68)、全因死亡(校正HR=0.94)、非心源性死亡(校正HR=0.90)风险较低相...
-
FDA指出应放宽罗格列酮使用限制
环球医学资讯

 1小时0条评论
1小时0条评论国食品和药物管理局(FDA)联合咨询小组的多数投票表示,糖尿病药物罗格列酮应该留在市场上,目前的处方限制应当降低,但不能全部取消。 FDA内分泌和代谢药物咨询委员会(EMDAC)和药物安全和风险管理(DSaRM)咨询委员会的26位成员中,13位成员认为应当保留市场上的...
-
FDA批准阿托伐他汀/依折麦布复方药
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论美国食品和药物管理局(FDA)批准了新的阿托伐他汀和依折麦布组成的复方降脂药。新药称为Liptruzet ,作为饮食结构改变的辅助治疗,用于低密度脂蛋白胆固醇水平升高的原发性或复合型高脂血症患者,也用于降低纯合子家族性高胆固醇血症(FH)患者的胆固醇水平。 Liptr...
-
FDA警告:慎用硫酸镁阻止早产
环球医学资讯

 1小时0条评论
1小时0条评论2013年5月30日,美国食品药品管理局(FDA)发布了一则警告,反对硫酸镁注射剂用于阻止孕妇早产的用药时间>5~7天,以免导致胎儿风险。胎儿可能出现低钙水平、骨质减少以及骨折,可导致损害的最短治疗时间尚不清楚。 硫酸镁已被批准用于预防先兆子痫患者癫痫以及控制子...
-
FDA批准两种药物治疗黑色素瘤
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论5月29日,美国食品和药物管理局批准了Tafinlar(dabrafenib)和Mekinist(trametinib)作为晚期或不可切除黑色素瘤的治疗。 黑色素瘤是皮肤癌中最危险的类型,是皮肤疾病死亡的首要原因。 美国国家癌症研究所预计,2013年美国将有76690人被确诊患黑色素瘤, 而其中94...
-
CFDA努力提升药品安监水平
环球医学资讯
 医药经济报
医药经济报 1小时0条评论
1小时0条评论5月13日,以“患者关爱与药物安全”为主题的药物信息协会(DIA)第五届中国年会在京召开。国家食品药品监督管理总局副局长尹力在会上表示:“中国政府高度重视药品安全工作,在本次机构改革中组建了国家食品药品监督管理总局,目的是优化监管资源、强...
-
CFDA 查处“新稳唐桑芪胶囊”等9种假冒保健食品
环球医学资讯

 1小时0条评论
1小时0条评论5月18日,国家食品药品监督管理总局(CFDA)发布信息,在“新稳唐桑芪胶囊、清脂胶囊、香港天天瘦、西木左旋肉碱巴西减肥咖啡、美迪佳牌靓体胶囊、三鞭四草三宝牌珍杞胶囊、乐意牌元盛唐泰胶囊、智奥牌减肥胶囊、可轻牌减肥胶囊”等9种产品中检出化学药物...
-
FDA:女性吃安眠药须减量
环球医学资讯

 1小时0条评论
1小时0条评论美国食品和药品管理局(FDA)于5月14日在其官方网站发文,提醒公众注意唑吡坦类安眠药服用后因体内清除时间具有个体差异,服药者次日早晨仍可能有头晕、嗜睡等不良反应,并提醒女性,尤其需要注意在医生指导下调整用量。 唑吡坦类安眠药包括安必恩和思诺思等。根据先前...
-
FDA批准AIC检测用于诊断糖尿病
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论美国食品和药品监督管理局今天宣布,卫生专业人员可以使用COBAS检测系统800蒂娜定量的HbA1cDx法来诊断糖尿病。 这是该机构批准用于诊断糖尿病的首例HbA1c检测。目前该检测被批准用于检测血糖控制,但不能用于诊断糖尿病。 FDA称,基于国际糖尿病专家的研究和建议,许...
-
CFDA要求收回违法广告保健食品广告批准文号
环球医学资讯
 环球医学编写
环球医学编写 1小时0条评论
1小时0条评论按照打击保健食品“四非”专项行动和8部委联合开展整治虚假违法医药广告专项行动的统一部署,国家食品药品监督管理总局(CFDA)对2012年和2013年第一季度电视、报纸保健食品违法广告监测情况进行了综合分析,数据显示,17个保健食品违法广告频次居高不下,...
-
FDA批准氯化镭-223治疗晚期骨转移型去势抵抗前列腺癌
环球医学资讯

 1小时0条评论
1小时0条评论2013年5月15日,美国食品与药物管理局(FDA)通过优先审查程序批准了氯化镭-223(商品名:Xofigo ;活性成分分子式223RaCl2)用于治疗晚期骨转移型去势抵抗前列腺癌,而不用于转移至其他器官的前列腺癌。 在一项单中心临床试验中,809例有症状的骨转移型去势抵抗前...
-
FDA批准戈利木单抗治疗中重度溃疡性结肠炎
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论2013年5月15日,美国食品与药物管理局(FDA)批准了肿瘤坏死因子(TNF))-α戈利木单抗(golimumab)新的适应证——之前治疗无效或需连续甾体类激素治疗的成人中重度溃疡性结肠炎。 英文链接:FDA Approves New Indication for Simponi http://www.cmt...
-
FDA批准戈利木单抗用于治疗难治性溃疡性结肠炎
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论美国食品和药品监督协会(FDA)批准了肿瘤坏死因子(TNF)-α抑制剂戈利木单抗新的适应症:用于治疗对既往治疗抵抗或需要持续类固醇治疗治疗的中度至重度溃疡性结肠炎患者。 此外,FDA还批准戈利木单抗用于治疗中度至重度活动性类风湿关节炎(RA)、牛皮癣性关...
-
FDA批准厄洛替尼伴侣诊断试剂盒上市
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论2013年5月14日,美国食品与药物管理局(FDA)批准了首个厄洛替尼伴侣诊断试剂盒用于鉴别出肿瘤中携带有表皮生长因子受体(EGFR)突变的非小细胞肺癌(NSCLC)及其转移的患者,约10%的非小细胞肺癌(NSCLC)患者出现EGFR突变。 确立cobas EGFR 突变检测法安全有效的临...
-
FDA批准Nymalize治疗蛛网膜下腔出血
环球医学资讯

 1小时0条评论
1小时0条评论2013年5月10日,美国食品与药物管理局(FDA)通过优先审查程序批准了Nymalize(尼莫地平口服液)用于治疗蛛网膜下腔出血。之前尼莫地平仅有充液胶囊剂型。 过去几年间FDA收到了静脉注射(IV)口服尼莫地平胶囊的液体成分而严重甚至致死的病例报告。静脉注射口服尼莫...
-
FDA:妊娠女性禁用丙戊酸产品预防偏头痛
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论5月6日,美国食品与药物管理局(FDA)提醒,女性妊娠期应用含有丙戊酸钠及其相关产品可致后代IQ评分降低,因此,这类药物被禁用于妊娠女性偏头痛的预防。相关产品包括丙戊酸钠、双丙戊酸钠和丙戊酸及其相应的非专利药品。FDA正和厂家一起修改含有丙戊酸盐药物的标签...
-
FDA将3类药物列入观察名单
环球医学资讯

 1小时0条评论
1小时0条评论近日,美国食品与药物管理局(FDA)将3种药物列入季度观察名单,其具体名称及可能不良反应如下。 疗多发性硬化药物芬戈莫德——噬血细胞综合征; 阿那格雷——尖端扭转性室速; 所有含有醋氨酚的药物——严重皮肤不良反应。 FDA将继续...
-
FDA:批准regorafenib 适应证扩展至晚期胃肠间质瘤…
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论2 月 15 日,FDA 扩展 regorafenib(瑞格非尼)适应证,批准其治疗无法手术切除并且 对伊马替尼和舒尼替尼无应答的晚期 GIST。 多激酶抑制剂 regorafenib 可阻断数种促 进 癌 细 胞 生 长 的 酶 类 。 一 项 涉 及 199 例 GIST 患 者 的 临 床 研 究 就 regorafenib ...
-
FDA批准阿托伐他汀/依折麦布复方片剂上市
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论近日,美国食品与药物管理局(FDA)批准了新型降脂复合片剂Liptruzet(有效成分包括托伐他汀和依折麦布)上市,用于和饮食控制一起治疗原发性或混合性高脂血症患者的低密度脂蛋白胆固醇(LDL—C)升高,以及降低纯合子家族性高胆固醇血症(FH)患者的胆固醇水平...
-
FDA批准阿托伐他汀/依折麦布复方片剂上市
环球医学资讯

 1小时0条评论
1小时0条评论近日,美国食品与药物管理局(FDA)批准了新型降脂复合片剂Liptruzet(有效成分包括托伐他汀和依折麦布)上市,用于和饮食控制一起治疗原发性或混合性高脂血症患者的低密度脂蛋白胆固醇(LDL—C)升高,以及降低纯合子家族性高胆固醇血症(FH)患者的胆固醇水平...
-
FDA:肝病患者禁用托伐普坦
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论2013年4月30日,美国食品与药物管理局(FDA)发布公告称,托伐普坦(tolvaptan)可导致肝损害,因此患者用托伐普坦应不超过30天;且有潜在肝脏疾病的患者不应服用该药。FDA已与厂家一起对托伐普坦药物说明书进行了上述修订。 新修订的说明书包含以下内容: 1、在用法...
-
FDA:抗癫痫药依佐加滨或与视网膜病变和皮肤色素减…
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论4月26日,美国食品与药物管理局(FDA)提醒公众,抗癫痫药物依佐加滨 (ezogabine)可引起皮肤色素减退和以视网膜颜色变化为特点的眼部异常。目前尚不清楚上述变化是否可逆。 FDA建议所有开始和正在服用依佐加滨的患者应进行基础和定期的眼部检查,如果患者出现了皮...
-
FDA批准首个SGLT2抑制剂降糖药上市
环球医学资讯

 1小时0条评论
1小时0条评论3月29日,美国食品与药物管理局(FDA)批准了首个新型降糖药钠-葡萄糖协同转运子2(SGLT2)抑制剂canagliflozin片剂,用于与饮食及运动一起改善成人2型糖尿病患者的血糖水平。 该药通过阻断肾脏对葡萄糖的重吸收,增加葡萄糖的排泄以降低血糖,其可改善糖化血红蛋白...
-
FDA专家小组建议批准每日1次慢性阻塞性肺病治疗复方药
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论美国食品和药物管理局(FDA)肺过敏药物咨询委员会建议批准皮质类固醇糠酸氟替卡松和长效β-激动剂vilanterol(FF/ VI100/25μg每日1次)干粉吸入剂(BREO ellipta,GlaxoSmithKline)用于治疗慢性阻塞性肺病(COPD)。 13名委员会成员以9比4的比例认同了FF/VI 1...
-
FDA更新羟考酮新剂型的说明书
环球医学资讯

 1小时0条评论
1小时0条评论2013年4月16日,美国食品与药物管理局(FDA)批准了奥施康定(通用名:盐酸羟考酮控释片)新剂型说明书的更新。更改后的说明书显示,因该药可能会导致滥用,为减少滥用可通过嗅吸法途径给药。 另外,与奥施康定的新剂型相比,原来的盐酸羟考酮控释片有同样的治疗获益...
-
达芬奇手术机器人接受FDA审查
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论美联社报道,达芬奇机器人手术系统去年出现了5例死亡,目前正在接受审查。 有关达芬奇机器人手术时出现问题的报告有增加趋势,这些手术可能包括前列腺切除、心脏瓣膜修复和器官移植,美国食品药品监督管理局(FDA)正在就此进行调查。2013年初,因出现的问题增多...
-
FDA批准Tecfidera治疗多发性硬化症
环球医学资讯

 1小时0条评论
1小时0条评论美国食品药品管理局(FDA)已批准一种新的每日2次口服药物——富马酸二甲酯用于治疗复发缓解型多发性硬化症(RRMS)。 将以Tecfidera作为商品名上市的该药物被认为具有预防大脑氧化应激的作用。此外,试验证据表明,它还具有抗炎和神经保护剂的作用。 Tecfider...
-
FDA批准首个SGLT2抑制剂降糖药上市
环球医学资讯

 1小时0条评论
1小时0条评论2013年3月29日,美国食品与药物管理局(FDA)批准了新型降糖药钠—葡萄糖协同转运子2(SGLT2)抑制剂canagliflozin片剂上市,用于与饮食及运动一起改善成人2型糖尿病的血糖水平。 Canagliflozin通过阻断肾脏葡萄糖的重吸收而增加糖的排泄,进而降低糖尿病患者的血...
-
FDA批准第3个多发性硬化症口服治疗药
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论美国食品和药物管理局(FDA)已批准二甲基延胡索酸(Tecfidera, Biogen Idec)用于治疗复发-缓解型多发性硬化症(MS)。 该药物是批准用于此适应症的第3个口服治疗药。芬戈莫德是第1个,于2010年9月获得批准,随后为特立氟胺,今年早些时候获得批准。 FDA药品评价和研...
-
FDA批准钆特酸葡甲胺上市
环球医学资讯

 1小时0条评论
1小时0条评论3月20日,美国食品与药物管理局(FDA)批准了钆特酸葡甲胺(Dotarem)用于年龄≥2岁的患者脑部、脊柱和其他相关组织的磁共振(MRI)成像显影。 一项纳入283例疑为中枢神经系统(CNS)异常、年龄≥2岁患者的临床试验确定了钆特酸葡甲胺的安全性和有效性。每例患者...
-
FDA批准淋巴结定位显影剂
环球医学资讯

 1小时0条评论
1小时0条评论2013年3月13日,美国食品与药物管理局(FDA)批准了放射性诊断显影剂99碍-tilmanocept (Lymphoseek)注射剂获准用于正在接受肿瘤引流淋巴结手术切除治疗的乳腺癌或黑色素瘤患者的淋巴结定位。 99碍-tilmanocept是30多年来首个获准用于淋巴结定位的新药。FDA已批准用...
-
FDA批准妥布霉素吸入粉剂治疗肺囊性纤维化
环球医学资讯

 1小时0条评论
1小时0条评论2013年3月22日,美国食品与药物管理局(FDA)批准了妥布霉素吸入粉剂(TOBI Podhaler)用于治疗合并有绿脓杆菌感染的肺部囊性纤维化患者。TOBI Podhaler是一种含妥布霉素粉剂的塑料手持吸入装置。该粉剂每日吸入两次,Podhaler装置可用28天。在再次恢复治疗前患者...
-
FDA批准新的含钆MRI造影剂
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论含钆造影剂(GBCA)用于MRI已经在许多国家广泛使用。近日,美国食品和药物管理局(FDA)宣布, 其已经批准GBCA上市。 据FDA,该造影剂钆特酸葡胺注射液(多它灵,Guerbet 公司)有助于放射科医生发现中枢神经系统(CNS)的异常病变。它被用于2岁或以上患者大脑、脊椎...
-
美国FDA提醒:滥用抗生素心脏会乱跳
环球医学资讯

 1小时0条评论
1小时0条评论阿奇霉素在临床上多被用于治疗咽炎、扁桃体炎、中耳炎等感染性疾病。据美国“健康日”网站3月12日报道,美国食品和药品管理局(FDA)近日提醒,阿奇霉素等大环内酯类抗生素可致心电活动异常,增加心脏病患者的死亡风险。 FDA的这次提醒起源于2012年5月发表...
-
FDA正在对肠促胰岛素类似物导致胰腺炎及癌前病变进…
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论美国食品和药物管理局(FDA)正在对肠促胰岛素类似物用于治疗2型糖尿病增加胰腺炎及癌前病变胰腺导管上皮化生风险进行评估。这些药物包括胰高血糖素样肽1(GLP-1)受体激动剂和DPP-4抑制剂,或者二肽基肽酶Ⅳ抑制剂,均为用于治疗成人2型糖尿病的新型药物。 在近日的...
-
FDA警告阿奇霉素可造成致命性心脏病风险
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论近日,美国食品和药物管理局(FDA)宣布,广泛使用的抗生素阿奇霉素(希舒美和Zmax,辉瑞)有导致潜在的致命性心律失常的风险,因此对于使用该药物的患者应仔细监测。 大环内酯类抗生素可能会导致异常的心电活动,有可能延长QT间期和触发一种罕见的称为尖端扭转型室...
-
FDA 批准治疗绝经后性交痛新药
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论近日,美国食品和药物管理局(FDA)宣布,其已批准奥培米芬(Osphena,盐野义制药公司)用于治疗绝经后妇女中度至严重的性交痛。 更年期性交疼痛与体内雌激素水平下降从而导致阴道萎缩相关,经常造成性交时疼痛。 奥培米芬是一种新型的选择性雌激素受体调节剂,可使...
-
FDA召回贫血治疗药Peginesatide
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论近日,美国食品和药物管理局(FDA)宣布,在报告贫血治疗药peginesatide(Omontys, Affymax 和武田制药)导致3人因过敏性反应而死亡后,厂家已开始主动召回该药。 2012年3月,FDA批准peginesatide用于治疗接受透析治疗的因慢性肾脏疾病引起贫血的成年患者。该注射药...
-
FDA批准新型硅凝胶填充乳房植入物
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论本周三,健康监管机构称他们批准了由Allergan公司生产的新型硅凝胶填充乳房植入物。 美国食品和药物管理局(FDA)批准Allergan公司的410种Natrelle植入物,以增加22岁及以上女性乳房的大小,并能重建任何年龄段的女性乳房组织。此次设计的硅凝胶比先前的坚固。FDA要...
-
美国FDA对缓释及长效阿片类药物使用的风险评估和减…
环球医学资讯

 1小时0条评论
1小时0条评论题目:美国FDA对缓释及长效阿片类药物使用的风险评估和缓和对策:赞成和反对以及前瞻欧洲(US Food and Drug Administration's Risk Evaluation and Mitigation Strategies for Extended-Release and Long-Acting Opioids: Pros and Cons, and a European Perspectiv...
-
FDA批准吡格列酮在美国销售
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论印度制药公司Zydus Cadila透露,他们最终收到了来自美国食品和药物管理局对降糖药吡格列酮HCI在美国市场销售的批准。 Zydus声称已经收到销售吡格列酮HCI片剂剂量为15 mg、30 mg和45 mg的批准。该公司补充说,根据来自IMS的数据,估计吡格列酮HCI片剂2012年的销售额达...
-
FDA将三种药物列入安全观察清单
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论近日,美国食品与药物管理局(FDA)因潜在严重风险征象及新安全信息而将三种药物添加入安全观察清单。 拉科酰胺(Lacosamide)适用于治疗癫痫和肝、肾损伤;FDA不良事件报告系统(FAERS)于2012年接收到其致中毒性表皮松解坏死症和中性粒细胞减少报告。 用于改善多发...
-
FDA批准视网膜假体——“仿生眼”
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论本周四,美国食品和药物管理局(FDA)批准了视网膜假体的销售权,视网膜假体能使晚期色素性视网膜炎(RP)的盲人避开路上的障碍且能阅读大的字体。 加利福尼亚州西尔马Second Sight医疗产品公司的设备制造商称,阿格斯II视网膜假体系统(阿格斯II)不能将RP患者的视...
-
FDA决定延长Rytary上市审核期限
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论近日,美国食品与药物管理局(FDA)决定延长特发性帕金森病(PD)治疗药物Rytary(卡比多巴-左旋多巴缓释剂)上市申请的审核期限。 Rytary研发商益邦制药公司称FDA已发出完全回复函。回复函指出,由于位于美国海沃德的设备涉及Rytary研发,因此在新药申请可能获批之...
-
FDA批准间质前体细胞治疗关节炎的2期临床试验
环球医学资讯

 1小时0条评论
1小时0条评论澳大利亚再生药物公司Mesoblast已经收到美国食品和药品监督局(FDA)的批准,开始进行评估治疗活动性类风湿性关节炎的异基因,或“现成的”,间质前体细胞(MPCs)单次静脉输注的2期临床试验。 预计该随机、双盲安慰剂对照试验将在2013年的第二个季度开展...
-
FDA批准急性偏头痛药物Zecuity在美国上市
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论NuPathe公司近日宣布,FDA批准Zecuity用于成人有或无先兆的偏头痛的急性治疗。该公司计划在2013年第4季度上市Zecuity,但目前尚未确定价格。 zecuity是舒马普坦的透皮贴剂,可以经皮肤输送至体内以达到疗效。 出处:BioCentury,2013,21(3) 原文链接:http://www....
-
癌症患者促红细胞生成素类药物治疗时患者的血红蛋白…
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论题目:癌症患者促红细胞生成素类药物治疗时患者的血红蛋白水平-美国食品药品管理局政策改变之后的变化(Hemoglobin Levels Triggering Erythropoiesis-Stimulating Agent Therapy in Patients with Cancer: the Shift After United States Food and Drug Administrat...
-
美FDA首推抗结核新药
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论2012年12月31日,美国食品与药物管理局(FDA)批准了40年以来第一种以新机制对抗结核的药物。但是,人们还不能高枕无忧,因为该药物大规模使用的安全性仍有待观察。 FDA批准的新药Bedaquiline专门针对患有耐多药性结核病(MDR TB)的病人,该类病人的疗程可达2年之久...
-
FDA批准阿格列汀3种不同制剂用于治疗2型糖尿病
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论2013年1月25日,美国食品与药物管理局(FDA)批准了选择性二肽基肽酶-Ⅳ(DPP-4)抑制剂阿格列汀(alogliptin)的3种制剂上市,用于改善成人2型糖尿病的血糖水平。这3种制剂分别为阿格列汀片、阿格列汀与盐酸二甲双胍固定剂量复合片剂和阿格列汀与吡格列酮复合片剂(...
-
FDA警告托伐普坦增加严重肝损害的风险
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论近日,美国食品和药物管理局(FDA)宣布,用于治疗临床显著血容量过多和血容量正常的低钠血症的托伐普坦,可带来不可逆和潜在致命性肝损伤的风险。 FDA表示,一旦发现患者报告乏力、食欲减退、右上腹不适、尿色深、黄疸或其他任何可能提示肝损伤的症状,临床医生应尽...
-
FDA批准Flublok疫苗用于预防季节性流感
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论美国食品和药物管理局(FDA)已批准蛋白质科学公司Flublok疫苗用于18~49岁成人预防季节性流感。Diamyd医疗持有蛋白质科学公司约8%的股份。 Flublok是一种基于重组蛋白的季节性流感疫苗,它是利用重组技术生产的第一个流感疫苗已获FDA批准上市。蛋白质科学公司计划...
-
FDA称全金属髋关节植入物可能会损坏软组织
环球医学资讯
 环球医学编写
环球医学编写 1小时0条评论
1小时0条评论美国的医疗监管机构表示,金属对金属的髋关节植入物可能会导致软组织损伤和疼痛,这可能会进一步导致更换假体的手术,并已召回几个进行人工髋关节置换的病例。 传统植入物是将陶瓷或金属球结合到一个塑料的骨窝中。全金属髋关节植入物比传统的植入物更耐用,但一些安...
-
非苯二氮卓类催眠药治疗成人失眠的有效性:美国食品…
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论标题:非苯二氮卓类催眠药治疗成人失眠的有效性:美国食品和药物管理局(FDA)数据的荟萃分析(Effectiveness of non-benzodiazepine hypnotics in treatment of adult insomnia: meta-analysis of data submitted to the Food and Drug Administration) 摘要 目的...
-
Fulyzaq获得FDA审批
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论Salix制药公司表示,美国食品和药物管理局(FDA)批准了药物Fulyzaq,其目的是治疗服用HIV和AIDS药物患者的腹泻。 Salix称,该药计划在2013年初开始销售此药。该公司表示,Fulyzaq最多可以有5年的市场独售权,这意味着在此期间将不再批准同类产品。 该药是用来治疗抗...
-
FDA批准药物的同时提醒大家提防假药
环球医学资讯
 环球医学编写
环球医学编写 1小时0条评论
1小时0条评论在新年开始之前,FDA已经公布了各种获批药品的注意事项。 Juxtapid是FDA最近批准用于治疗高胆固醇的药物。该药主要是辅助治疗一种罕见的遗传性疾病。FH基金会主席Katherine Wilemon表示,美国FDA批准的Juxtapid将为HoFH患者和他们的家庭带来希望。她还表示,与这种疾...
-
治疗胆固醇紊乱新药获FDA批准
环球医学资讯
 环球医学编写
环球医学编写 1小时0条评论
1小时0条评论Aegerion制药公司推出了一种新药Juxtapid,该药用于治疗一种导致坏胆固醇水平极高的罕见疾病。现在,此药已通过美国FDA的首肯。 在美国,有近3000人受到胆固醇紊乱这种疾病的影响。血液滤过治疗并不是很有效,而且受害者多在30岁左右因心脏病发作或中风导致过早死亡...
-
治疗短肠综合征的新药Gattex获得FDA批准
环球医学资讯
 环球医学编写
环球医学编写 1小时0条评论
1小时0条评论Gattex(teduglutide,替度鲁肽)用来治疗短肠综合征已获得美国食品和药物管理局(FDA)的批准,对小和/或大肠切除术后造成的营养问题是一个很好的治疗形式。 Gattex是用来帮助改善肠道吸收的,且每天只需给药一次。另外两个用于治疗短肠症的药物——生长...
-
FDA批准达菲用于2周大的婴儿
环球医学资讯
 环球医学编写
环球医学编写 1小时0条评论
1小时0条评论美国食品和药物管理局(FDA)已批准达菲在两周大婴儿中的使用。 达菲已被批准用于成人和1岁以上的儿童,但最新批准将扩大该药在婴儿中的使用,这些婴儿均表现出流感症状,如鼻塞、咳嗽、咽痛、发热和全身酸痛。FDA药物评价与研究中心的Edward Cox说,虽然1岁以上的儿...
-
FDA批准的用药指导的实用性(J Gen Intern Med. 201…
环球医学资讯

 1小时0条评论
1小时0条评论题目:FDA批准的用药指导的实用性(Usability of FDA-Approved Medication Guides) 背景:用药指导是一种必要的文件,分发给患者用以传播与某种处方药物相关的严重风险。关于这类信息充分指导患者安全用药的效果罕有研究。 目的:旨在研究用药指导的可读性、适宜性...
-
前列腺癌药物镭-223待FDA审批
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论据悉,德国制药商拜耳公司于上周五表示,要求美国监管机构批准其一种实验性前列腺癌药物,这种药物最终可能产生超过10亿欧元(约合13.1亿美元)的年销售额。 拜耳习惯于叫Alpharadin的镭-223氯化物,旨在针对标准激素疗法不能治疗的前列腺癌骨转移患者。 拜耳公司于...
-
FDA审查戒烟药Chantix
环球医学资讯
 环球医学编写
环球医学编写 1小时0条评论
1小时0条评论18个月前,全球最大制药商辉瑞公司(PFE)生产的戒烟药Chantix被曝出可能与心血管疾病风险增加有关,美国食品和药物管理局(FDA)终于表示将对其进行审查。 2011年6月,有研究显示,服用该药的人比未服药的人更易患心血管疾病,研究一经发表,该机构首先发布了警告。FD...
-
FDA批准Cabozantinib用于治疗甲状腺癌
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论据悉,美国食品和药物管理局(FDA)于上周四批准了Exelixis公司的Cabozantinib用于治疗已扩散到身体的其他部分的甲状腺髓样癌。 作为公司的主导产品,Cabozantinib是一种口服药物,旨在限制癌组织的血液供应,并阻止癌细胞的生长和扩散途径。 在纽约股市交易中,Exel...
-
流感疫苗Flucelvax获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论美国食品与药品管理局(FDA)已经批准诺华公司面向年龄≥18岁个体患者使用的流感病毒疫苗Flucelvax。Flucelvax是一种衍生的细胞培养疫苗。 Flucelvax采用全规模细胞培养生产技术,该技术是惯用鸡蛋做培养基生产疫苗的一种替代生产法。细胞培养技术不是采用鸡蛋,而...
-
FDA批准首个治疗周围血管病的支架上市
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论2012年11月15日,美国食品与药物管理局(FDA)批准了Zilver PTX药物洗脱周围血管支架上市,该器械是首个获准治疗周围血管病(PAD)所致的股、腘动脉狭窄或闭塞的药物洗脱支架。 Zilver PTX支架包括一个自扩张金属导管,可将动脉撑开。支架外表面包被药物为紫杉醇,可...
-
FDA接受Navidea重新提交的Lymphoseek的新药申请
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论11月14日,专注于精密诊断用放射性药物研究的Navidea生物制药公司(NYSE MKT:NAVB)宣布,美国食品和药物管理局(FDA)已经接受了该公司于2012年10月30日重新提交的Lymphoseek ((Technetium Tc 99m Tilmanocept))注射液的新药申请(NDA)。FDA在一份声明中表示,...
-
FDA专家:Zohydro可能增加成瘾风险
环球医学资讯
 环球医学编写
环球医学编写 1小时0条评论
1小时0条评论美国食品和药物管理局(FDA)的一个专家小组建议医疗机构不再使用Zogenix公司生产的止痛药Zohydro,因为服用该药的患者可能存在高度成瘾的风险。 该小组成员以11-2投票结果,认为Zogenix公司勉强达到了FDA安全性和有效性的目标,但担心该药物可能成为其他阿片类止痛...
-
FDA:达比加群和华法林出血风险相似
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论2012年11月2日,美国食品与药物管理局(FDA)发布安全信息称,在减少非瓣膜病性心房颤动患者卒中风险方面,应用达比加群酯相关的出血发生率并不高于华法林相关的出血风险。此结果与RE-LY研究结果一致。 RE-LY研究显示,达比加群酯150mg(每日两次)的每年致命出血发...
-
FDA批准高三尖杉酯碱皮下注射剂上市
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论10月26日,美国食品与药物管理局(FDA)通过加速审批程序批准了“孤儿药”高三尖杉酯碱(omacetaxine mepesuccinate)用于治疗成人慢性髓性白血病(CML)。Synribo预期用于那些至少用2种酪氨酸激酶抑制剂药物(TKIs)治疗后疾病仍有进展的患者。 该药为皮下注...
-
FDA批准首个治疗症状性玻璃体黄斑粘连药上市
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论10月17日,美国食品与药物管理局(FDA)批准了首个用于治疗症状性玻璃体黄斑粘连(VWA)的药物奥克纤溶酶(ocriplasmin,商品名Jetrea)上市。 Jetrea可降解眼中参与VMA发生的蛋白质。这些蛋白质的降解有助于玻璃体与黄斑的分离,从而减少眼牵拉感的发生频率。该病的另...
-
厄贝沙坦片获FDA审批
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论卢平制药公司的血管紧张素Ⅱ受体拮抗剂厄贝沙坦片上市获FDA批准。厄贝沙坦片是赛诺菲-安万特公司治疗高血压的仿制药。 据悉,卢平制药公司的孟买子公司,最终获美国食品和药物管理局(FDA)批准厄贝沙坦片的上市,该药是赛诺菲-安万特公司的仿制药,剂量与其通用的相...
-
西酞普兰导致QTc间期延长以及尖端扭转型室性心动过…
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论题目:西酞普兰导致QTc间期延长以及尖端扭转型室性心动过速:我们应该如何应对最新的FDA裁决?(Citalopram, QTc Interval Prolongation, and Torsade de Pointes. How Should We Apply the Recent FDA Ruling?) 目前,西酞普兰的生产企业和美国的食品药品管理局均...
-
FDA:滥用止痛药Opana能导致血栓性血小板减少性紫癜
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论据路透社消息,美国卫生监管部门本周四发出警告,人们滥用静脉注射止痛药Opana ER,可能有致血液病症的风险,严重者可导致肾功能衰竭或死亡。 Opana是一种强效阿片类止痛药(含有羟吗啡酮),是由远藤制药公司生产的。 食品和药物管理局称,某些情况下血液病症(血栓...
-
FDA批准Regorafenib治疗转移性结直肠癌
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论Regorafenib是一种口服多激酶抑制剂,9月27日,美国食品与药物管理局(FDA)宣布,已批准将其用于治疗转移性结直肠癌。批准的适应证为治疗转移性结直肠癌患者,“这些患者之前已接受氟嘧啶、奥沙利铂和伊立替康为基础的化疗、1种抗VEGF治疗,此外,如为KRAS野生型...
-
FDA在一项法规提案中扩大了可标识心脏保健作用的植…
环球医学资讯

 1小时0条评论
1小时0条评论12月10日消息 - 针对植物甾醇可以降低冠心病(CHD)发病风险的保健作用,FDA在相关法规提案中做出了大幅修改,扩大了可以标识这种保健作用的富含植物甾醇的传统食品和膳食补充剂的种类。 这项关于植物甾醇保健作用的法规提案将在12月8日的《联邦公报》(Federal...
-
FDA:抗抑郁的仿制药与原药安非他酮的效价不等
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论10月8日环球医学--据悉,美国食品和药物管理局(FDA)称,新数据表明,广泛应用的抗抑郁药安非他酮的仿制药与葛兰素克公司生产的原药是不等价的。 仿制药Budeprion XL 300 mg(盐酸安非他酮缓释片)是由Impax 实验室公司生产,美国Teva制药公司销售。 上周三,FDA在...
-
降糖药Actoplus片的等价仿制药获FDA 审批
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论9月29日环球医学--盐酸吡格列酮和盐酸二甲双胍片是武田全球研究开发中心的Actoplus片剂的等价仿制药。 据悉,印度阿拉宾制药公司已经获得美国食品和药物管理局(FDA)对盐酸吡格列酮15mg (每片剂量)/500mg和盐酸二甲双胍15mg (每片剂量)/850mg的临时审批。该产品将在...
-
美国FDA成立抗生素顾问委员会
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论9月27日环球医学--抗生素顾问委员会将协助发展和修订抗生素发展相关指南。 据悉,美国食品和药品管理局已经通知内部顾问委员会将支持新抗生素的研发,此为重要的公共保健目标和该机构应优先解决的问题。 作为抗生素顾问委员会协助发展和修订与抗生素研发相关指南的工...
-
美FDA警告增稠剂Simply Thick用于任何年龄婴儿均可…
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论圣路易斯(MD Consult)——2012年9月18日,美国食品药品管理局(FDA)发布了一则关于使用SimplyThick的最新安全性通告,这是一种帮助解决吞咽困难的增稠剂产品。2011年5月,FDA曾发布安全警告,建议公众不要用该产品喂养早产儿,因其可能引发坏死性小肠结肠炎...
-
FDA 批准Prolia注射液的新用途
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论9月21日环球医学--据悉,世界上最大的生物技术公司——Amgen公司表示,美国健康监管部门批准了Prolia 注射液作为增加骨折高风险期男性骨质疏松症患者骨密度的新用途。 骨质疏松症患者发生严重的骨质变脆变薄。 目前,美国已经批准Prolia治疗绝经后妇女骨折...
-
FDA批准新型乳腺超声成像系统上市
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论2012年9月18日,美国食品与药物管理局(FDA)批准了首个用于检测致密乳房组织的乳腺超声成像系统上市。该装置可联合标准乳房X线摄影技术检测那些乳房X线检查阴性且无乳腺癌症状的女性患者,有助于医务人员检测出更小的肿瘤。 somo-v ABUS显像适用于之前没有进行过乳...
-
FDA为出血性病毒(埃博拉和马尔堡病毒)药物研发提…
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论Sarepta Therapeutics公司表示,美国卫生监管部门为两种治疗马尔堡和埃博拉病毒的实验性药物授予快速监管审查通道。 该公司股价在周二上午纳斯达克收盘时上涨了7%达15.95美元。 美国食品和药物管理局(FDA)指定的快车道加速监管审查,其目的是治疗严重的疾病并填补...
-
仿制药兰索拉唑延迟缓释胶囊获FDA批准上市
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论Wockhardt生物制药公司已收到美国食品和药物管理局(US FDA)对其营销15毫克和30毫克剂量单位的兰索拉唑延迟缓释胶囊的最终审批,该药用于治疗消化性溃疡。兰索拉唑是商品名为兰索拉唑缓释胶囊剂的仿制药名称,由武田公司在美国销售。 Wockhardt公司将立即推出该产品...
-
FDA批准抗抑郁仿制药依地普伦
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论9月17日环球医学--Lupin公司的依地普伦片是规格与Forest公司的草酸艾司西酞普兰片等价的仿制药,用于严重抑郁障碍患者的急性和维持治疗。 Lupin公司的制药主管称,自美国FDA向市场推出Forest公司实验用药草酸艾司西酞普兰片5mg、10mg和20mg的仿制药后,Lupin子公司的...
-
便秘治疗药物新选择利那洛肽获FDA批准
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论美国食品与药物管理局(FDA)于8月30日批准利那洛肽用于治疗成人慢性特发性便秘和IBS-C,该药也可用来缓解IBS-C患者的腹痛。获批药物利那洛肽为胶囊制剂,空腹服用,每日1次,餐前服用须至少提前半小时。 美国国立卫生研究院(NIH)统计数据显示,约有6300万人受到慢...
-
低钠血症药物利希普坦待FDA审批
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论美国食品和药物管理局(FDA)的一位临床评论员于周二建议该机构批准Cornerstone治疗公司的药物用于治疗特定条件下的低钠血症。 FDA的临床评论员、医学博士许女士称,利希普坦应被批准用来治疗由于体内水分过多导致的低钠水平。不过,这种药物不应该被批准用于心脏衰...
-
心脏用药Vascepa等待FDA批准其独家销售权
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论9月11日环球医学--Amarin公司称,美国的医疗监管机构还未决定授予其心脏用药Vascepa的独家销售权,导致其股价在盘后交易中下跌3%。 该公司称,通过与美国食品药物管理局(FDA)的谈判,该公司不希望FDA的黄皮书增加对Vascepa的独家销售权的监管。 FDA出版的黄皮书的...
-
FDA批准孤儿药QLT091001治疗视网膜色素变性
环球医学资讯

 1小时0条评论
1小时0条评论12月9日消息 - 前沿医学资讯网据THE MEDICAL NEWS网站报道,QLT公司8日宣布美国FDA已准予其口服合成类维生素A QLT091001作为指定孤儿药用于治疗视网膜色素变性(RP)。前一日FDA还批准该药作为指定孤儿药用于莱伯氏先天性黑蒙(LCA)。QLT091001是一种口服合成类...
-
FDA专家组支持降低减肥手术的BMI标准
环球医学资讯

 1小时0条评论
1小时0条评论12月9日消息 - 12月3日,美国食品药品管理局(FDA)的胃肠道与泌尿外科器械专家组以8比2的投票结果支持将Lap-Band可调节胃束带的适用范围扩大至体重指数(BMI)更低且无合并症的对象。 此次拟新增的适用对象为年龄≥18岁、无合并症且BMI≥35 kg/m2以及具有一种或...
-
FDA咨询委员会投票支持Contrave治疗肥胖症
环球医学资讯

 1小时0条评论
1小时0条评论12月9日消息 - 前沿医学资讯网据THE MEDICAL NEWS网站报道,Orexigen公司和武田制药12月8日宣布,美国FDA内分泌和代谢药物咨询委员会(EMDAC)以13:7投票支持Contrave用于治疗肥胖症:现有数据充分表明Contrave【纳曲酮缓释剂(SR)/安非他酮SR】长期用于超重和...
-
FDA批准Qutenza用于缓解带状疱疹引起的长期疼痛
环球医学资讯

 1小时0条评论
1小时0条评论<?xml:namespace prefix = st1 ns = "urn:schemas-microsoft-com:office:smarttags" />12月11日消息 – 美国食品药品管理局(FDA)已批准Qutenza(辣椒碱)8%贴剂上市。这种外用皮肤贴剂可用于缓解疱疹后神经痛(PHN),一种带状疱疹发病后的常见严重并发症。<?xml...
-
FDA批准伯舒替尼治疗慢性髓性白血病
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论2012年9月4日,美国食品与药物管理局(FDA)批准了新的“孤儿药”伯舒替尼(bosutinib)用于治疗慢性髓性白血病(CML),后者以老年人发病居多。 伯舒替尼预期用于那些慢性期、加速期或急变期Ph染色体阳性的CML患者,这些患者对其他治疗包括伊马替尼(imat...
-
FDA批准治疗晚期前列腺癌新药Xtandi
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论2012年8月31日,美国食品和药物管理局(FDA)批准了Xtandi(enzalutamide)用于治疗晚期转移性或复发的去势抵抗性前列腺癌患者,和为了减少睾酮已进行了药物或手术治疗的患者。 Xtandi通过FDA的优先审查程序获准,适用于抗肿瘤药多西他赛治疗后的前列腺癌患者。 FDA...
-
FDA批准治疗晚期前列腺癌新药Xtandi
环球医学资讯
 医学论坛网
医学论坛网 1小时0条评论
1小时0条评论2012年8月31日,美国食品和药物管理局(FDA)批准了Xtandi(enzalutamide)用于治疗晚期转移性或复发的去势抵抗性前列腺癌患者,和为了减少睾酮已进行了药物或手术治疗的患者。 Xtandi通过FDA的优先审查程序获准,适用于抗肿瘤药多西他赛治疗后的前列腺癌患者。 FDA...
-
FDA警告:肺动脉高压药物Revatio禁用于儿童
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论美国卫生监管部门建议禁止把肺动脉高压(PAH)的药物Revatio用于17岁以下儿童的治疗,称在使用高剂量时,它有更高的死亡风险。 尽管这种药物从未被批准用于治疗儿童PAH,美国食药监局的警告是对标示外使用该药物。 Revatio与该公司治疗勃起功能障碍的药物枸橼酸西地...
-
FDA 批准Afinitor Disperz用于治疗儿童脑肿瘤
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论8月30日环球医学--据悉,健康监管机构批准了瑞士制药——诺华股份有限公司的药物Afinitor Disperz用于治疗1岁及1岁以上儿童一种罕见的脑肿瘤。 美国FDA称,该药被推荐用于治疗复合型结节性硬化病,此病是一种罕见的遗传病,导致肿瘤在大脑和其他重要器官生...
-
美国FDA批准罗匹尼罗缓释片仿制药治疗帕金森氏症
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论美国FDA已批准Wockhardt公司销售用于治疗帕金森氏症的2mg、4 mg、6 mg、8mg和12mg剂量的含盐酸罗匹尼罗的缓释片仿制药。罗匹尼罗缓释片是罗匹尼罗XL品牌的通用名,由葛兰素史克在美国销售。 Wockhardt公司日前宣布,它将很快推出相应的产品。 据IMS健康组织,这个产...
-
FDA首次批准脐带血干细胞治疗自闭症
环球医学资讯
 环球医学编辑
环球医学编辑 1小时0条评论
1小时0条评论8月23日环球医学--库萨特医学研究所和世界上最大的干细胞库——脐带血注册中心(CBR),正在进行FDA首次批准的以儿童自身脐带血干细胞治疗其自闭症的临床试验。此项全新的、安慰剂对照的研究,旨在评估注射脐带血干细胞改善患儿语言和行为的能力。 小儿神...
-
FDA延迟三个月审批治疗关节炎药物Tofacitinib
环球医学资讯
 环球医学编辑
环球医学编辑 1小时0条评论
1小时0条评论据悉,美国食品药品管理局(FDA)延迟三个月审批辉瑞公司临床试验期治疗风湿性关节炎药物Tofacitinib,此药是该公司最有前途的新药之一。 今年7月,辉瑞公司透露,FDA寻求该药临床试验数据的“常规”分析,因此延迟三个月或可超过审理部门的最后期限即8月2...
-
白血病药Lemtrada治疗多发性硬化症向FDA递交申请
环球医学资讯
 环球医学编辑
环球医学编辑 1小时0条评论
1小时0条评论8月21日环球医学--据悉,赛诺菲罕见疾病部基因酶公司目前正推出用不同剂量的治疗白血病的药物Campath治疗多发性硬化症,注册商标为Lemtrada。 该公司发言人称,撤出意味着阻止Campath标示外用作多发性硬化病的药物。在许多欧洲国家已着手实行,且9月4日将在美国生效...
-
第一种2型糖尿病仿制药Actos获FDA批准
环球医学资讯
 环球医学编辑
环球医学编辑 1小时0条评论
1小时0条评论8月20日环球医学--Actos作为治疗2型糖尿病的第一种仿制药,已获美国食品和药物管理局批准,用于帮助改善2型糖尿病患者的血糖水平。 审理部门透露,已单独给予广州南新制药有限公司和美国Mylan制药公司180天时间生产15mg、30mg和45mg剂量强度的药物。Actos片剂在美国...
-
巧克力糖浆商标标示信息不准确被FDA警告
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论8月16日消息--环球医学据悉,美国食品和药物管理局称,Hershey公司巧克力糖浆的营养商标不符合监管指导方针。 2月14日FDA给该公司发出警告信,并于周二公布,Hershey公司的糖浆+钙及其糖浆糖无维生素和矿物质强化的商标违反了联邦法律。 FDA称,该公司不得在商标上使...
-
FDA批准Marqibo治疗费城染色体阴性急性淋巴细胞白血病
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论8月10日消息--环球医学据悉,美国食品和药物管理局于本周四表示,已批准Marqibo用于治疗一种称为费城染色体阴性急性淋巴细胞白血病的成人罕见类型白血病。 Marqib作为化疗药物长春新碱的仿制药,将成为Talon公司的第一个商业产品。 该公司主要由Warburg Pincus和 Dee...
-
FDA延迟对首个狼疮治疗药Benlysta的决定
环球医学资讯

 1小时0条评论
1小时0条评论12月8日消息 - 前沿医学资讯网据悉,人类基因组科学公司(HGSI)和葛兰素史克(GSK)表示,美国食品和药物管理局(FDA)对他们的治疗狼疮候选药物Benlysta作出是否批准上市的决定还要三个多月的时间,该机构将决策日期推迟到明年3月10日左右。 这两家公司表...
-
FDA批准孟鲁司特钠咀嚼片的第一个仿制药
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论8月8日消息--环球医学据悉,美国食品和药品监督管理局已批准孟鲁司特钠咀嚼片的第一个仿制药,用于治疗儿童和成人的哮喘症状及室内和室外过敏症状。 尽管审理部门警告说,孟鲁司特钠应该被仅用于治疗哮喘突然发作,因为其导致严重的副作用,FDA表示,孟鲁司特钠药的...
-
大肠癌治疗药物Zaltrap获FDA批准
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论8月6日消息--环球医学据悉,近日,美国食品和药物管理局(FDA)已批准用于治疗转移性大肠癌的药物Zaltrap ,该药物已由赛诺菲和Regeneron制药公司合作开发。 赛诺菲表示,Zaltrap可能对化疗无应答的大肠癌患者有效。大规模临床试验表明,接受Zaltrap联合 FOLFIRI化疗...
-
FDA拒绝批准甲基纳曲酮新的适应症
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论8月2日消息--环球医学据悉,美国食品和药物管理局(FDA)拒绝批准甲基纳曲酮溴化物(Relistor,Salix制药公司和Progenics制药)用于治疗成人慢性非癌性疼痛患者的阿片类药物引起的便秘(OIC)。 FDA于上周五发出了关于补充新适应症申请的完整的答复信,表示需要更多...
-
FDA拒绝扩大Regeneron公司痛风药物Arcalyst的使用
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论8月1日消息--环球医学据悉,Regeneron制药公司表示,美国监管机构拒绝批准其药物Arcalyst扩大应用于预防痛风急性发作,并要求该公司提供更多的临床数据。 当美国食品和药物管理局的专家小组关注到该公司只完成了16周的研究,全票反对拒绝了由其在五月初审批的药物。 ...
-
FDA专家小组建议批准ocriplasmin用于治疗玻璃体黄斑…
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论7月27日消息 - 环球医学据悉,美国食品和药物管理局(FDA)专家小组近日推荐ThromboGenics NV公司的ocriplasmin用于治疗玻璃体黄斑粘连——一种可导致失明的年龄相关性视力障碍。 FDA外部专家顾问委员会得出结论认为,该种商品名为Jetrea的注射用药物,...
-
FDA审查新药平均速度要比EMA或加拿大卫生部更快且数…
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论题目:新疗法的监管审查:3个监管机构的比较(Regulatory review of novel therapeutics--comparison of three regulatory agencies) 背景:新修订的处方药消费者付费法案集中于改善美国食品药品监督管理局(FDA)新药申请的审查过程。 方法:利用FDA、欧盟药品管理...
-
FDA要求警惕MS药物的癫痫发作风险
环球医学资讯
 爱唯医学网
爱唯医学网 1小时0条评论
1小时0条评论美国食品药品管理局(FDA)对多发性硬化症(MS)药物达伐吡啶(dalfampridine)上市后不良事件报告的评估结果表明,患者开始接受推荐剂量的达伐吡啶治疗后不久,癫痫发作风险即达到最高程度。 7月23日FDA发布声明指出,癫痫发作是该药物的已知风险,大部分患者的癫痫发作出...
-
FDA批准Strides Arcolab公司生产仿制氟尿嘧啶注射液
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论7月25日消息 - 环球医学据悉,总部位于班加罗尔的制药公司Strides Arcolab透露,其已获美国食品和药物管理局(FDA)批准,生产用于治疗各种癌症的仿制氟尿嘧啶注射液。 IMS最新公布的数字显示,仿制氟尿嘧啶的美国市场行情超过1千4百万美元。氟尿嘧啶通过干扰制造...
-
FDA批准mTOR抑制剂依维莫司治疗乳腺癌
环球医学资讯
 爱唯医学网
爱唯医学网 1小时0条评论
1小时0条评论7月20日美国食品药品管理局(FDA)宣布,已批准依维莫司的适应证扩大至治疗激素受体阳性、HER2阴性晚期乳腺癌绝经后女性患者。 依维莫司(Afinitor)为哺乳动物雷帕霉素靶蛋白(mTOR)抑制剂,此次获准可与依西美坦(Aromasin)联合用于来曲唑(Femara)或阿那曲唑(Arimidex)治...
-
FDA积极支持和批准新的治疗肥胖症的药物和治疗方案
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论7月20日消息-环球医学据悉,肥胖保健连续体(OCC)的成员对美国FDA在确保用于治疗超过9300万的美国肥胖患者治疗方案的安全问题的持续、积极主动的做法表示感谢。 7月17日,Qsymia(芬特明和托吡酯)获美国FDA批准,标志着在不到一个月的时间内美国FDA第二次批准一种...
-
FDA批准结肠镜检查前肠道准备新产品
环球医学资讯
 爱唯医学网
爱唯医学网 1小时0条评论
1小时0条评论随着一种粉末状产品获得美国食品药品管理局(FDA)批准,结肠镜检查前结肠清洁有了新的选择,其用法是在水中溶解后分2次使用。Ferring制药公司将以Prepopik这一商品名进行销售,从2012年10月起可购买到该产品。 Prepopik是匹克硫酸钠(一种兴奋性泻药)与氧化镁、无水柠...
-
FDA批准400毫克规格速普乐胶囊上市
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论7月9日消息 - 环球医学据悉,药品制造商Lupin公司宣布,其新药申请(NDA)已获美国卫生监管机构批准,允许其在美国市场上出售400毫克规格的速普乐胶囊。 Lupin集团总裁兼常务董事Nilesh Gupta说:“这一新剂型将增加我们日益增长的速普乐经销权,并为医疗服...
-
季节性流感疫苗Agriflu 获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论12月7日消息 - 11月27日,美国食品药品管理局(FDA)宣布,批准疫苗Agriflu用于预防由甲型和乙型流感病毒引起的疾病。该疫苗适用于年龄≥18岁的人群。 FDA通过加速审批程序批准了诺华疫苗公司生产的Agriflu。诺华公司表示,接种该疫苗后血液中产生的抗体水平可...
-
FDA讨论金属对金属髋关节置换安全性
环球医学资讯
 爱唯医学网
爱唯医学网 1小时0条评论
1小时0条评论6月28日,美国食品药品管理局(FDA)顾问专家组在结束为期2天的会议时建议,在评估患者是否存在与金属对金属髋关节植入相关的不良反应时,应与骨科医生一起快速开展体格检查、常规X线检查,以及标准和特殊实验室检查。 实验室检查应包括标准血液检查以及评估沉降率和C...
-
FDA再次延迟对血栓预防药物Eliquis的批准
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论6月27日消息 - 环球医学据悉,美国食品和药物管理局(FDA)已再次延迟对辉瑞和百时美施贵宝公司开发的一种实验性药物的批准,FDA表示它需要更多的关于该药物有效性的研究的信息。 一些分析师认为,此种名为Eliquis的药物要优于目前在市场上出售的两种新的血栓预防...
-
FDA专家小组建议批准carfilzomib治疗骨髓瘤
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论6月21日消息 - 环球医学据悉,FDA的一个咨询委员会以11-0、1票弃权的表决结果建议批准carfilzomib用于难治性多发性骨髓瘤。 肿瘤药物咨询委员会的成员判断认为,该药有希望带来的获益——对已经穷尽所有其他疗法的患者的进展性疾病进行控制—&mdas...
-
FDA需要制药商进行另一项关于Vyndaqel的试验
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论6月20日消息 - 环球医学据悉,辉瑞公司表示,美国食品和药物管理局(FDA)已要求该公司对其神经退行性疾病治疗药物Vyndaqel进行另一项临床试验。 辉瑞公司称,FDA需要其研究Vyndaqel治疗转甲状腺素蛋白家族性淀粉样多发性神经病的疗效,转甲状腺素蛋白家族性淀...
-
FDA工作人员质疑抗血栓药semuloparin的价值
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论6月20日消息 - 环球医学据悉,美国药物审评人员质疑赛诺菲SA的semuloparin注射剂用于化疗中癌症患者预防血栓的价值。 食品和药物管理局的工作人员说,在semuloparin的临床试验中,只有少数人实际上有血栓问题,大多数人死于其他问题。 “这些研究结果对在...
-
FDA批准新型二联疫苗Menhibrix
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论6月15日消息 - 环球医学据悉,美国食品和药物管理局于当地时间6月14日批准了一种联合疫苗——Menhibrix用于6周至18个月大的婴幼儿,以预防脑膜炎奈瑟菌抗血清C群和Y群以及b型流感嗜血杆菌引起的侵袭性疾病。 脑膜炎奈瑟菌引起的疾病(脑膜炎球菌病)和b...
-
FDA批准Perjeta治疗晚期乳腺癌
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论6月11日消息 - 环球医学据悉,美国食品和药物管理局于近日批准一种新的抗HER2疗法——Perjeta(帕妥珠单抗)用于治疗HER2-阳性的晚期(转移性)乳腺癌。 Perjeta旨在用于那些既往未接受过抗HER2疗法或化疗治疗的转移性乳腺癌患者;Perjeta与曲妥珠单抗...
-
FDA拒绝批准肉瘤药物ridaforolimus
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论6月7日消息 - 环球医学据悉,美国食品和药物管理局(FDA)已发出一封完整的答复信,以需要另外的数据为由,拒绝批准ridaforolimus(Taltorvic,由默克公司在Ariad制药的授权下出品)的申请。 口服哺乳动物雷帕霉素靶蛋白(mTOR)抑制剂是一种研究中的药物,用于≥4...
-
FDA批准地特胰岛素用于2~5岁1型糖尿病患儿
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论5月58日消息 - 环球医学据悉,据地特胰岛素(Levemir)的制造商称,该药已获得FDA批准用于年龄2~5岁的1型糖尿病患儿。 诺和诺德公司表示,此次批准使地特胰岛素成为唯一获得FDA批准作为5岁及以下儿童基础治疗的胰岛素类似物。 此次批准基于一项涉及82例糖尿病患...
-
FDA专家小组反对批准利伐沙班用于急性冠脉综合征
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论5月28日消息 - 环球医学据悉,FDA的一个咨询委员会以6-4(1票弃权)的表决结果反对将Xa因子抑制剂利伐沙班(拜瑞妥)标签中的适应症扩大到治疗急性冠脉综合征(ACS)。 心血管和肾脏药物咨询委员的投票结果有些令人惊讶,因为两天前发布的FDA工作人员审查对利伐沙...
-
FDA工作人员审查建议扩大利伐沙班的适应症
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论5月23日消息 - 环球医学据悉,FDA的工作人员审查已同意将利伐沙班(拜瑞妥)的适应症扩大到用于减少急性冠脉综合征患者的血栓心血管事件风险。 FDA心血管和肾脏药物咨询委员会将在周三召开会议,以讨论杨森制药的这种每日口服一次Xa因子抑制剂的补充申请。利伐沙...
-
FDA将审查阿奇霉素的心血管风险
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论5月18日消息 - 环球医学据悉,美国食品和药物管理局(FDA)近日宣布,其将审查一项新的研究,该研究显示,服用阿奇霉素(希舒美,辉瑞公司)的患者与服用阿莫西林、环丙沙星,或不服用任何抗生素的人相比,其突发心源性猝死的风险略微增加。 此项观察性研究近日发...
-
FDA修订多发性硬化症口服药芬戈莫德的标签
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论5月15日消息 - 环球医学据悉,FDA表示,多发性硬化症药物芬戈莫德(Gilenya)与反应致死相关;具有某些心脏风险因素的患者不应服用这种口服药物。 去年出现了服用该药的死亡报告,FDA已承诺就此事进行调查。 FDA在周一宣布,该机构仍然不知道是否是芬戈莫德导致...
-
FDA专家顾问小组建议批准减肥药lorcaserin
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论5月14日消息 - 环球医学据悉,美国政府卫生监管机构顾问于5月10日建议批准销售一种新的减肥处方药,尽管他们为该药的心脏风险担忧,该药有望成为美国十余年来的首个新型减肥处方药。 FDA的一个专家顾问小组以18比4的投票建议批准Arena制药公司的lorcaserin,专家...
-
FDA专家小组建议批准HIV复方药Truvada
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论5月11日消息 - 环球医学据悉,本周四,FDA咨询委员会以压倒性结果达成一致,建议应当批准一种抗-HIV复方药片用于健康人群预防HIV感染。 这种复方药(Truvada,特鲁瓦达)由恩曲他滨和替诺福韦组成,该委员会认为其安全性与耐受性良好,每日使用有助于高风险人群预...
-
FDA警告:来那度胺可增加第二原发癌风险
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论5月8日消息 - 环球医学据悉,FDA警告称,来那度胺(Revlimid)作为多发性骨髓瘤的维持治疗与第二原发癌的风险增加相关。 FDA称,在三项试验中,新近诊断为多发性骨髓瘤的患者最初接受化疗和造血干细胞移植,然后接受来那度胺维持性治疗或安慰剂,结果显示,第二原...
-
FDA工作人员质疑痛风药利纳西普
环球医学资讯

 1小时0条评论
1小时0条评论5月8日消息 - 环球医学据悉,美国药物评论员表示,Regeneron制药公司防止痛风的药物有效,但质疑其副作用以及是否足以帮助患者。 上周五,FDA的工作人员表示,该注射用药物Arcalyst(利纳西普)计划只使用16周来防止痛风-这是首个以这么短的时间来治疗该疾病的药物...
-
FDA批准Elelyso治疗1型戈谢病
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论5月3日消息 - 环球医学据悉,美国食品和药物管理局于5月1日批准Elelyso(taliglucerase阿尔法)作为长期酶替代疗法治疗一类戈谢病(Gaucher disease,高雪病)——一种罕见的遗传疾病。 戈谢病发生在不能产生足够葡糖脑苷脂酶的人群中。这种酶缺乏导会...
-
FDA批准新的勃起功能障碍药物Stendra
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论5月2日消息 - 环球医学据悉,近日,美国食品和药物管理局(FDA)批准了一种可能起效更快的伟哥和其他勃起功能障碍治疗药物的替代药物。 该药物的商品名为Stendra,由Vivus公司生产,与伟哥和希爱力属于同一类药品。这些药物均抑制相同的酶——PDE5,通过增...
-
FDA更新非那雄胺标签
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论4月17日消息 - 环球医学据悉,FDA扩大了用于治疗前列腺肥大及男性型脱发的药物非那雄胺的警告标签,FDA说,一些服用该药的男性在停止用药后持续出现性方面的副作用。 非那雄胺是默克公司的前列腺药物保列治和脱发治疗药物保法止中的主要成分。这种药物已被警告与...
-
FDA将静脉血栓栓塞事件风险加入含屈螺酮的口服避孕…
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论4月11日消息 - 环球医学据悉,美国食品和药物管理局(FDA)近日宣布,含屈螺酮(一种人工合成的孕激素)的口服避孕药与其他类型的孕激素药相比,可能与较高的静脉血栓风险有关。 FDA说,它会将此警告添加至所有含屈螺酮的避孕药的标签中,其中包括优悦(Yaz)、优...
-
年龄与FDA批准的长效β2肾上腺素受体激动剂的风险(P…
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论题目:年龄与FDA批准的长效B2肾上腺素受体激动剂的风险(Age and Risks of FDA-Approved Long-Acting beta2-Adrenergic Receptor Agonists) 目的 根据年龄组别,测定在美国市场销售的用于治疗哮喘的长效β(2)肾上腺素受体激动剂在治疗重症哮喘时发生相关不良...
-
FDA专家小组首肯膀胱过度活动症新药mirabegron
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论4月6日消息 - 环球医学据悉,美国FDA咨询委员会以7-4的表决结果(1名成员弃权)认为膀胱过度活动症药物mirabegron的益处大于风险。 该FDA生殖健康药物咨询委员会在周四下午投票认为,虽然与安慰剂相比,mirabegron只提供了“边缘”的益处,但它为膀胱过...
-
FDA批准诺和平妊娠用药等级为B级
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论4月5日消息 - 环球医学据悉,美国食品和药物管理局(FDA)已批准诺和诺德公司的诺和平(地特胰岛素[rDNA源]注射液)妊娠用药等级为B级,表明当诺和平用于患有糖尿病的孕妇时,并不会增加对胎儿的伤害的风险。 此次标签更新使诺和平成为首个妊娠用药等级为B级的基...
-
FDA警告60岁以上成年人使用西酞普兰不应超过20mg/天
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论3月31日消息 - 环球医学据悉,FDA警告说,选择性5-羟色胺再摄取抑制剂(SSRI)西酞普兰(喜普妙,Forest Laboratories)在用于60岁以上的成年人时,用药剂量不应超过20mg/天,因为该药有使QT间期延长的潜在风险。 由于这种QT间期延长的风险,因此不推荐患有特定疾...
-
FDA将抗HIV药物Etravirine的适应症扩大到儿童
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论3月29日消息 - 环球医学据悉,美国食品和药物管理局已经扩大etravirine(Intelence)的适应症,批准etravirine与其他抗逆转录病毒药联用治疗6岁及6岁以上儿童的HIV-1感染。 制造商杨森公司的一份声明称,这次扩大适应症意味着该药也适用于携带对非核苷类逆转录...
-
FDA在他汀类药物标签中加入糖尿病及记忆力减退警告
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论3月28日消息 - 环球医学据悉,美国卫生监管部门将在诸如立普妥等广泛使用的降胆固醇药物的标签中加入警告,以表明这些药物可能会升高血糖水平,并可能导致记忆力减退。 FDA宣布,将修改他汀类药物标签上的安全信息,这些药物包括辉瑞公司的立普妥,阿斯利康公司的...
-
FDA批准Omontys治疗成人透析患者的贫血
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论3月28日消息 - 环球医学据悉,美国食品和药物管理局于27日批准Omontys(peginesatide)治疗慢性肾脏病(CKD)透析成年患者的贫血,贫血患者体内的健康红血细胞不够充足。 Omontys是一种新的红细胞生成刺激剂(ESA),有助于红细胞的形成。该药通过刺激骨髓产生更...
-
FDA批准GreenGene F治疗A型血友病的3期临床试验
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论3月23日消息 - 环球医学据悉,韩国生物制药公司绿十字公司的IND申请已于2012年2月28日获美国FDA批准,该IND申请是关于启动一项重组VIII因子产品GreenGene F(Berotocog alfa)在美国治疗A型血友病的3期临床试验。 GreenGene F是一种重组人B区缺失凝血因子VIII,目...
-
FDA专家小组支持硫酸长春新碱脂质体注射液用于成人A…
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论3月22日消息 - 环球医学据悉,美国FDA咨询委员会已勉强通过了硫酸长春新碱脂质体注射液(Marqibo)用于治疗一种罕见的成人急性淋巴细胞白血病。 该FDA肿瘤药物咨询委员会以7-4的表决结果(两名专家弃权)认为,对于病情两次及两次以上复发或是之前至少两种其他...
-
Votrient获得FDA批准用于晚期软组织肉瘤的治疗
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论3月21日消息 - 环球医学据悉,FDA肿瘤药物咨询委员会(ODAC)已建议批准Votrient(帕唑帕尼)用于软组织肉瘤这种罕见癌症的治疗。如果FDA(食品和药物管理局)遵循该委员会的建议,那么已经接受化疗的患者将适用帕唑帕尼。FDA没有遵循该委员会建议去做的义务,但FD...
-
FDA批准首个Boniva的仿制药用于治疗或预防骨质疏松症
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论3月21日消息 - 环球医学据悉,美国食品和药物管理局于3月19日批准了Boniva(伊班膦酸钠)片的第一种仿制药;Boniva片是一种每月应用一次,用于预防或治疗绝经后妇女骨质疏松症的药物。 骨骼疾病中最常见的类型是骨质疏松症,该病以骨量减低和骨组织结构退化为特点...
-
FDA称肉瘤药物Ridaforolimus已达到研究的主要终点
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论3月19日消息 - 环球医学据悉,美国卫生监管部门于上周五表示,默克制药公司的ridaforolimus片剂达到了主要研究终点——使转移性软组织肉瘤或骨肉瘤患者的病情进展或死亡风险降低了25%。 一份食品和药物管理局公布的经过工作人员审查的文件也表示,临床...
-
FDA批准首个依地普仑仿制药
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论3月15日消息 - 环球医学据悉,美国食品和药物管理局(FDA)于3月14日批准首个Lexapro(来士普,依地普仑片)的仿制药用于治疗成人的抑郁症和广泛性焦虑症。 抑郁症的症状特点是干扰人的工作、睡觉、学习、进食及享受一次愉快活动的能力。抑郁症往往在人的一生中反...
-
希雷公司撤回向FDA提交的关于Replagal治疗法布里病…
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论3月15日消息 - 环球医学据悉,希雷公司于周三宣称,该公司已撤回了向美国食品和药物管理局(FDA)提交的关于批准其法布里病(一种罕见的遗传性疾病)治疗药物的申请,因为FDA或许需要更多的临床研究。 该药物名为Replagal,是治疗法布里病的酶替代疗法,该疾病会...
-
FDA咨询委员会支持镇痛药抗神经生长因子的开发
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论3月13日消息 - 环球医学据悉,FDA的一个咨询委员会已经以21-0的投票结果赞成应当对研究中的抗神经生长因子(抗-NGF)类药物继续进行开发以用于疼痛的治疗,尽管该类药物与关节的相关不良事件有关。 目前尚无抗-NGF类药物获得批准,但有3家公司都投入到他们的开发...
-
FDA批准首种基于细胞的制品治疗成人口腔粘膜牙龈疾病
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论3月12日消息 - 环球医学据悉,美国食品和药物管理局于3月9日批准了GINTUIT——首种由异体人体细胞(供体与患者无关)和牛胶原蛋白制成的基于细胞的制品。GINTUIT适用于成人粘膜牙龈疾病接受手术治疗时所造成的血管创面的外用治疗(非埋植型)。 GINTUIT...
-
FDA正考虑让更多的常用药物以非处方形式出售
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论3月9日消息 - 环球医学据悉,根据美国监管机构正在考虑的一项计划,一些治疗最常见的慢性疾病,如高胆固醇和糖尿病的处方药,有望成为非处方药。 如果定案,这将是一项重大的政策转变,美国食品和药物管理局正在公开征求意见,以找到使这些药物更容易获得的方法,...
-
FDA拒绝批准Qutenza辣椒素贴剂治疗HIV相关疼痛
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论3月9日消息 - 环球医学据悉,美国卫生监管部门拒绝批准NeurogesX公司提取于辣椒的贴剂用于治疗HIV相关疼痛,并需要新的试验数据。该公司表示,将会削减一半员工,以节省成本。 美国食品和药物管理局告知NeurogesX公司,要想获得Qutenza用于治疗HIV相关疼痛的批准...
-
FDA批准Surfaxin用于预防早产儿呼吸窘迫综合征
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论3月7日消息 - 环球医学据悉,美国食品和药物管理局于3月6日批准Surfaxin(lucinactant)用于预防早产儿的呼吸窘迫综合征(RDS),RDS是一种呼吸障碍。 早产儿的肺部无法产生足够的表面活性剂,而表面活性剂是一种覆盖在肺脏内部并有助于保持肺脏张开的液体。如果...
-
FDA:阿托伐他汀/依折麦布合剂还需更多数据
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论3月6日消息 - 环球医学据悉,美国食品和药物管理局将不会批准一种新的研究中的降脂药,该药是阿托伐他汀和依折麦布的合剂。该机构向默克公司发布了一封有关此新药申请(NDA)的完整回复函,该函阐明,在对申请进行了全面审查后,还需额外数据。 在这一点上,还没...
-
FDA新批准2种用于帮助消化的胰酶制品
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论3月2日消息 - 环球医学据悉,两种用于帮助食物消化的新的胰酶制品——Ultresa(胰脂肪酶)和Viokace(胰脂肪酶)于3月1日获得美国食品和药物管理局批准。 Ultresa是一种缓释胶囊,用于治疗儿童及成人囊肿性纤维化(该病是以一种严重的遗传疾病,会影响...
-
FDA要求默克公司在30天内提交西格列汀动物研究的最…
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论3月1日消息 - 环球医学据悉,FDA在一封警告信中责备默克公司未能遵守承诺对与其糖尿病药西格列汀(Januvia, Janumet)相关的胰腺炎风险进行动物研究。 该公司“未能遵守批准的时间表,并…未能拿出合理的理由来说明该公司为什么不进行另外的测试以进一...
-
FDA批准首个四价流感疫苗
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论3月1日消息 - 环球医学据悉,一种用于2岁~49岁人群预防季节性流感的疫苗——FluMist四价疫苗于本月29日获得美国食品和药物管理局批准。FluMist四价流感疫苗是第一种包含4种流感病毒株(2种甲型流感病毒株和2种乙型流感病毒株)的疫苗。 与已经获批的Flu...
-
FDA专家小组称明年的流感疫苗将更新两株病毒
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论3月1日消息 - 环球医学据悉,据美国政府的一个咨询小组称,明年的流感疫苗应保留目前的H1N1病毒株,但应进行更新以预防新的H3N2病毒株和乙型流感病毒谱系。 本周二,FDA疫苗与相关生物制品顾问委员会一致(18-0)批准了将甲型流感作为2012-2013年三价疫苗的一个组...
-
FDA宣布对他汀类药物标签中的安全性进行变更
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论3月1日消息 - 环球医学据悉,美国食品和药物管理局于28日宣布更改一些广泛使用的降胆固醇药(名为他汀类药物)的标签。 此类产品与饮食和锻炼一起应用,有助于降低人体的“坏”胆固醇(低密度脂蛋白胆固醇)。这些产品包括:立普妥(阿托伐他汀)、来适...
-
FDA工作人员不建议批准低血压药物Northera
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论2月23日消息 - 环球医学据悉,卫生监管人员不建议批准切尔西治疗国际有限公司的低血压药物Northera在美国上市,这使得该公司的股价下跌超过14个百分点。 一项由FDA的工作人员进行的审查说,这种统称为屈昔多巴的治疗药物在临床试验中没有表现出持久的有效性,并在...
-
FDA专家小组建议批准减肥药Qnexa
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论2月23日消息 - 环球医学据悉,Vivus公司的一种实验性减肥药于周三赢得了美国FDA专家小组的支持,为13年来监管机构或将首次批准减肥药燃起了希望。 食品和药物管理局的外部专家小组以20比2的投票建议FDA批准Qnexa,用于治疗肥胖及伴随肥胖的健康问题。 虽然并不是...
-
FDA工作人员称抗胆碱药对COPD有效
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论2月22日消息 - 环球医学据悉,抗胆碱药aclidinium溴化物似乎能够有效治疗慢性阻塞性肺病(COPD),但FDA的工作人员在审查中发现,患者的数据库较小和心血管事件引起了关注。 在FDA肺-过敏药物咨询委员会在周四举行会议之前,该报告就已被公布;该委员会将在会议上...
-
FDA批准Korlym用于内源性库欣综合征患者
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论2月21日消息 - 环球医学据悉,近日,Korlym(米非司酮)获得美国食品和药物管理局批准,用于控制内源性库欣综合征成年患者的高血糖(高血糖症)。该药被批准用于患有2型糖尿病或对葡萄糖不耐受并且不适合手术或对之前的手术没有反应的内源性库欣综合征患者。korlym...
-
FDA关注减肥药Qnexa的长期副作用
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论2月21日消息 - 环球医学据悉,美国食品和药物管理局(FDA)已对减肥药Qnexa(一种芬特明和托吡酯的复方制剂)以及该药的长期使用与出生缺陷风险及其心脏影响的可能关联表示关注。这是FDA再次对Qnexa进行审查,2年前FDA拒绝了Qnexa提交的批准申请。 FDA的一个咨询小...
-
美国艾滋病保健基金会对FDA作出加速审查艾滋病药Tru…
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论2月17日消息 - 环球医学据悉,美国最大的非营利性医疗组织HIV/艾滋病保健基金会(AHF)近日表示,该组织对食品和药物管理局(FDA)授予吉利德科学公司扩大Truvada应用的新药申请(NDA)加速审查的决定表示失望和沮丧。Truvada是一种强力艾滋病药物,而吉利德科学公...
-
FDA受理审查溃疡性结肠炎药物Uceris的新药申请
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论2月17日消息 - 环球医学据悉,近日,Santarus公司宣布FDA已经受理审查其Uceris的新药申请(NDA)。Uceris是Santarus与Cosmo科技有限公司(Cosmo制药股份公司的子公司)合作开发的,用于诱导活动期溃疡性结肠炎的缓解。 “溃疡性结肠炎是一种严重的慢性疾病,...
-
FDA受理Tafamidis葡甲胺的新药申请
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论2月16日消息 - 环球医学据悉,辉瑞公司于近日宣布,美国食品和药物管理局(FDA)已经受理其tafamidis葡甲胺的新药申请(NDA)审查,tafamidis葡甲胺是该公司研究的一种用于治疗转甲状腺素蛋白家族性淀粉样神经病变(TTR-FAP)的新型口服治疗药物。TTR-FAP是一种罕...
-
Zioptan滴眼药获FDA批准
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论2月15日消息 - 环球医学据悉,默克公司宣布,美国食品和药物管理局(FDA)已批准其0.0015% Zioptan(他氟前列素滴眼液),这是第一种不含防腐剂的前列腺类似物滴眼液。 Zioptan被批准用于降低开角型青光眼(OAG)或高眼压症患者升高的眼压(IOP)。FDA 对Zioptan...
-
FDA向诺华发出关于扩大Menveo应用范围的完全回应函
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论2月15日消息 - 环球医学据悉,诺华公司已收到一封来自美国食品和药物管理局(FDA)的完全回应函,此函是关于该公司将Menveo(脑膜炎双球菌[血清型A、C、Y和W-135群]寡糖白喉CRM197结合疫苗)的应用范围扩大至2个月以上婴幼儿的申请。Menveo已在美国获批用于年龄在2...
-
FDA授予抗HIV感染药物Truvada优先审查资格
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论2月15日消息 - 环球医学据悉,吉利德科学公司宣布,美国食品和药物管理局(FDA)已接受Truvada(恩曲他滨/富马酸替诺福韦酯)的补充新药申请(SNDA),并授予该种日用一次用于暴露前预防(PrEP)的药物6个月的优先审查资格,PrEP可减少未感染成人中的HIV-1感染风险...
-
FDA批准一种治疗男性睾酮水平低下的外用凝胶
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论2月15日消息 - 环球医学据悉,美国食品和药物管理局的一名发言人说,美国药品监管部门批准了BioSante制药公司和Teva制药的一种新型睾酮凝胶。 生物-T-凝胶是一种每日一次的外用凝胶,通过皮肤吸收来治疗男性睾酮水平低下——一种名为性腺功能低下症的疾...
-
奥巴马要求增加业界对FDA的资金支持
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论2月15日消息 - 环球医学据悉,美国总统奥巴马周一要求将食品和药物管理局的预算提高17%,但增加的预算大部分将来自企业,而不是纳税人的钱。FDA提出的45亿美元预算将近一半将来自检查以及药品和医疗器械公司所付的费用,如辉瑞公司、美敦力公司。 在2013财年,联...
-
FDA发布避免肝素污染的新指南
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论2月13日消息 - 环球医学据悉,上周五,美国监管机构发布了安全生产血液稀释剂肝素的新指南。 肝素是一种血液稀释剂,用于数百万患者来预防其在肾透析和心脏手术期间的血液凝块,它通常是从猪肠中生产的。 在2007年11月开始出现肝素过敏反应的报告后,美国食品和...
-
FDA批准降脂药阿托伐他汀钙片的首个非专利药
环球医学资讯

 1小时0条评论
1小时0条评论12月2日消息 - 环球医学据悉,美国食品和药品管理局(FDA)于11月30日批准兰伯西实验室有限公司(Ranbaxy Laboratories Ltd.)制造降脂药阿托伐他汀钙片(atorvastatin calcium,商品名立普妥,Lipitor)的首个非专利药,制剂为10 mg、20 mg、40 mg和80 mg(stre...
-
FDA警告称丙肝药物会削弱HIV药物的疗效
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论2月10日消息 - 环球医学据悉,FDA警告称,一种治疗丙型肝炎的新药与一些HIV药物同时使用会削减后者的疗效,反之亦然。 FDA在一份药品安全通讯中警告说,在boceprevir(Victrelis)和利托那韦(诺韦)激发的抗-HIV蛋白酶抑制剂之间存在重大药物相互作用。 Bocepre...
-
FDA颁布生物仿制药产品开发指南草案
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论2月10日消息 - 环球医学据悉,美国食品和药物管理局于2月9日颁布了三项生物仿制药产品开发指南文件草案,以帮助美国业界对此类产品的开发。 “FDA已经采取一种创新的方法来支持新的生物仿制药产品上市时开发过程中的每一个步骤,”FDA药物评价与研究中...
-
FDA专家小组否决了Qutenza辣椒素贴片用于HIV患者的…
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论2月10日消息 - 环球医学据悉,使用来源于辣椒的止痛产品来治疗累及了许多HIV患者的四肢疼痛于近日遭到FDA的外部专家小组的否决。 投票结果为12:0,FDA咨询委员会发现,没有临床数据显示出实质性的证据来证明NeurogesX公司的的Qutenza辣椒素贴片能有效地治疗艾滋病...
-
FDA专家小组否决了Dacogen(达珂)治疗白血病的用途
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论2月10日消息 - 环球医学据悉,美国卫生监管机构的一个独立咨询专家小组说,日本制药商卫材有限公司的Dacogen(达珂)并没有显示出治疗一种血液肿瘤的良好的风险效益特点。 该独立专家小组以10比3的投票否决了该药这一用途,并表达了对该药治疗急性髓细胞白血病时...
-
头虱洗液伊维菌素获FDA批准
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论2月9日消息 - 环球医学据悉,美国FDA已批准0.5%伊维菌素洗液(Sklice)治疗头虱,适用于年龄≥6个月的患者。 洗液使用一次10分钟,患者不用梳理头虱幼虫。 据制药商赛诺菲-巴斯德的一份声明称,这种抗寄生虫制剂通过与无脊椎动物的神经细胞和肌肉细胞相结合,...
-
FDA警告称PPI可能会引起难辨梭状芽孢杆菌相关性腹泻
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论2月9日消息 - 环球医学据悉,美国FDA本月8日警告说,使用质子泵抑制剂(PPIs)可能会增加“难辨梭状芽孢杆菌”相关性腹泻的风险,这包括常用的药品,如耐信、Prilosec(奥美拉唑)和Prevacid(兰索拉唑)。 FDA在评价了其不良事件报告系统的数据之后发...
-
FDA不能确定骨治疗药Xgeva是否也可用于延缓癌细胞的…
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论2月8日消息 - 环球医学据悉,FDA审核员说,他们不能确定安进公司的骨治疗药Xgeva是否也应被批准用于延缓癌细胞的骨扩散。 Xgeva是一种化学名称为狄诺赛麦的注射药物,它被批准用于防止已扩散到骨头的癌症所造成的骨折,而不是防止或延缓癌症扩散。它被看作是世界...
-
FDA加强对膳食补充剂的控制
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论2月8日消息 - 环球医学据悉,FDA已经收紧了对膳食补充剂准入的控制,并已开始着手规范在美国上市的膳食补充剂中的膳食成分的工作。 根据美国FDA发出的新膳食成分(NDI)通知草案,任何打算销售或开发含新成分的补充剂的组织必须告知FDA。 FDA将彻底评估新成分的...
-
FDA顾问小组将在第二季度讨论减肥药lorcaserin
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论2月3日消息 - 环球医学据悉,Arena 制药公司近日表示,该公司最近重新提出lorcaserin的批准申请,FDA的一个顾问委员会将在今年第二季度举行会议,讨论该公司的此种实验性减肥药物。 Arena公司目前正在与日本制药商卫材有限公司合作开发lorcaserin,lorcaserin是曾...
-
FDA初步批准Mylan公司生产仿制版本立普妥
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论2月3日消息 - 环球医学据悉,Mylan公司表示,食品和药物管理局初步批准了该公司生产的仿制版本的降胆固醇药立普妥的若干规格,立普妥是世界上的顶级畅销药物。 根据美国专利法,在专利保护失效后的头180天内,兰伯西实验室有限公司是唯一有资格与品牌药立普妥和沃...
-
FDA批准格列卫扩大在罕见消化道癌症中的应用
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论2月1日消息 - 环球医学据悉,美国食品和药物管理局今天授予格列卫(伊马替尼)常规批准,以用于CD117阳性的胃肠道间质瘤(GIST)成年患者在手术切除后的治疗。FDA这一近日的举动还强调了,当接受格列卫36个月而非12个月的标准治疗时,整体上患者的生存率有所增加。...
-
FDA批准Kalydeco用于罕见囊性纤维化的治疗
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论2月1日消息 - 环球医学据悉,美国食品和药物管理局于近日批准Kalydeco(ivacaftor)用于治疗囊性纤维化跨膜转导调节器(CFTR)基因发生了特定的G551D突变的年龄≥6岁的罕见囊性纤维化(CF)患者。 CF是一种严重的遗传病,该病会累及肺和其他器官,最终导致患者...
-
FDA接受了bosutinib的审查申请
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论2月1日消息 - 环球医学据悉,全球最大制药商辉瑞公司说,食品和药物管理局将审查其潜在的白血病治疗药物bosutinib作为首次尝试其他疗法的成年人的一个可能的选择。 该公司表示,bosutinib是一种口服药,每日服用一次以治疗一种慢性粒细胞白血病,慢性粒细胞白血病...
-
中国产西药注射剂首次通过FDA认证
环球医学资讯
 环球医学编写
环球医学编写 1小时0条评论
1小时0条评论1月30日消息 - 环球医学据悉,美国食品和药品管理局(简称FDA)北京办事处于29日证实,江苏恒瑞医药股份有限公司生产的抗肿瘤药伊立替康注射剂已通过FDA美国通用名药物注册认证,成为通过该认证的首款中国产西药注射剂。FDA发言人帕特•艾尔辛那威说,恒瑞公司获批...
-
FDA最终批准一种仅需每周注射一次的药物用于治疗糖…
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论1月29日消息 - 环球医学据悉,上周五,美国食品和药物管理局最终批准了Amylin制药公司的糖尿病药物Bydureon,该药每周注射一次,为2型糖尿病患者提供血糖控制。在此之前,该药的申请曾于2010年被拒绝过两次,当时FDA要求Amylin制药公司回去进行一项关于Bydureon对...
-
FDA批准Inlyta用于治疗晚期肾癌
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论1月29日消息 - 环球医学据悉,FDA(食品和药物管理局)于近日宣布已批准Inlyta(阿西替尼,axitinib)用于治疗其他药物无效的晚期肾细胞癌(肾细胞癌的一种类型)患者。Inlyta是由制药业巨头辉瑞公司生产并销售的。 肾恶性上皮细胞肿瘤(Renal cell carcinoma)&m...
-
FDA拒绝批准Dapagliflozin
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论1月20日消息 - 环球医学据悉,美国食品和药物管理局(FDA)拒绝批准新型糖尿病药物dapagliflozin,要求联合开发商百时美施贵宝公司和阿斯利康公司提供更多的有关药物的风险收益状况的数据。 美国食品药物管理局近日就研发主办人的用于治疗成人2型糖尿病的新化合物...
-
FDA批准Voraxaze用于缓解甲氨蝶呤的毒性反应
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论1月18日消息 - 环球医学据悉,美国卫生监管部门近日批准了英国专业制药商BTG公司的一种药物,此种药物能帮助癌症患者摆脱化疗的毒性水平。 该药物名为Voraxaze,其有助于消除经过高剂量化疗药治疗后肾功能已受损害的患者体内的甲氨蝶呤。甲氨喋呤通常由肾脏排出体...
-
FDA关于心脏PET扫描显像剂CardioGen-82引起的辐射过…
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论1月16日消息 - 环球医学据悉,根据FDA的初步报告,引起CardioGen-82(一种心脏PET显像剂)过量辐射暴露的原因可能是使用的错误,而非制造的问题。 两名患者曾使用过CardioGen-82进行心脏成像,他们在通过美国边境时被探测到具有放射性,此后,美国FDA在7月份警告...
-
FDA发出关于淋巴瘤药物brentuximab的警告
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论1月16日消息 - 环球医学据悉,美国FDA已向医疗专业人士发出关于淋巴瘤药物brentuximab(Adcetris,西雅图遗传学公司)的警告。 已有两例新的进行性多灶性白质脑病(PML)病例被报告,这是一种罕见但严重的脑部感染。由于PML可以致死的严重性,FDA已将一个新的强调...
-
FDA向国会提交用户费用提案
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论1月16日消息 - 环球医学据悉,美国卫生监管部门表示,他们已于近日向国会提交了一项新的提案,该提案是关于制药商将如何资助新品牌药品、常规仿制药品和新一代非专利生物技术治疗的审查。 与此同时,他们仍没最终确定收取多少“用户费用”用于医疗器械...
-
FDA已批准VivaGel®治疗细菌性阴道炎的3期试验
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论1月11日消息 - 环球医学据悉,Starpharma公司近日宣布,已获FDA关于其VivaGel ®治疗细菌性阴道炎(BV)的3期临床研究设计的书面协议,该研究隶属于FDA的特别治疗方案评估(SPA)计划。 SPA声明是FDA发布的一份联合声明,即该3期临床研究用以支持监管部门批准...
-
IMM-124E试验获FDA批准
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论1月11日消息 - 环球医学据悉,Immuron有限公司宣布,美国FDA已批准其提交的一份着手开展一项2b期临床试验的试用性新药(IND)申请,该项2b期临床试验是关于牛初乳衍生疗法(IMM-124E)用于治疗非酒精性脂肪性肝炎(NASH)和脂肪肝的试验。 该试验是一项双盲、安慰...
-
Glenmark获得FDA批准在美国销售非专利孟鲁司特
环球医学资讯

 1小时0条评论
1小时0条评论12月1日消息 - 环球医学据悉,Glenmark制药公司透露,该公司获得了美国FDA准许其供应非专利孟鲁司特钠片治疗哮喘和季节性过敏的批准,该公司将于明年8月起在美国销售此药。 Glenmark说,其将在明年8月默克公司的专利期满时制造此种药片。 这种药片是默克...
-
Letermovir被FDA授予孤儿药地位
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论1月10日消息 - 环球医学据悉,AiCuris公司宣布,其生产的对抗人巨细胞病毒(HCMV)的新型抑制剂AIC246(letermovir)已被美国指定为孤儿药,用于预防高危人群的HCMV病毒血症和疾病。这一决定是由FDA的孤儿产品开发办公室于2011年12月12日做出的。 letermovir最近...
-
FDA批准raltegravir用于治疗感染HIV的儿童
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论1月9日消息 - 环球医学据悉,最近美国食品和药物管理局(FDA)批准raltegravir用于治疗感染HIV的儿童和青少年,raltegravir是一种能够延缓HIV感染播散的抗逆转录病毒药物,这为治疗感染HIV的儿童提供了一个新的武器。美国纽约州立大学石溪分校医学院儿科教授兼研究...
-
FDA拒绝Theravance公司抗肺炎新药的申请
环球医学资讯

 1小时0条评论
1小时0条评论<?xml:namespace prefix = st1 ns = "urn:schemas-microsoft-com:office:smarttags" />12月1日消息 – 据悉,药物开发商Theravance表示美国卫生监管机构拒绝其治疗院内获得性肺炎药Vibativ (Telavancin)的申请。<?xml:namespace prefix = o ns = "urn:schemas-mic...
-
FDA将AMT的血友病基因疗法方案认定为孤儿药
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论1月5日消息 - 环球医学据悉,人类基因疗法领域的领导者Amsterdam Molecular Therapeutics(泛欧证券交易所:AMT)于日前宣布,美国食品和药物管理局(FDA)已将该公司治疗B型血友病的基因疗法方案认定为孤儿药。在美国,基于监管部门的批准,孤儿认定可以为该药的...
-
丙肝治疗药物ACH-1625获FDA快速审批资格
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论01月05日消息 - 环球医学据悉,Achillion制药公司正在开发的一种治疗慢性丙型肝炎的疗法获得了快速审批资格,使监管机构可对其进行更快地审查。 Achillion公司说,此种名为ACH-1625的药物现正进行中期阶段临床试验。快速审批资格可使药物开发者分部分地向FDA提交...
-
FDA邀安进公司参加关于XGEVA治疗去势抵抗前列腺癌申…
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论12月31日消息 - 环球医学据悉,近日,安进公司(纳斯达克股票代码:AMGN)宣布,美国食品和药物管理局(FDA)已邀请该公司参加于2012年2月8日举行的肿瘤药物咨询委员会(ODAC)会议,讨论XGEVA®(denosumab)用于治疗高骨转移风险的去势抵抗性前列腺癌男性(CRPC...
-
速释型透粘膜芬太尼制品的单一共享风险评估及降低策…
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论12月31日消息 - 环球医学据悉,近日,美国食品和药物管理局批准了一项单一共享的风险评估及降低策略(REMS),该REMS是为速释型透粘膜芬太尼(TIRF)制品而设立的。这一共享系统将取代单独的REMS,处方医师和药房在注册之后只需进入一个系统,这将缓解医疗卫生系统的...
-
FDA批准Prevnar 13疫苗用于成人
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论12月31日消息 - 环球医学据悉,美国卫生监管部门批准将辉瑞公司的重磅炸弹药物Prevnar疫苗的适用范围扩展,接种于50岁以上的成人,用以对抗肺炎、脑膜炎和其他由肺炎球菌引起的疾病。 Prevnar 13旨在对抗13种被称为肺炎链球菌或肺炎球菌的细菌。由肺炎球菌有机体...
-
FDA要求医护人员在给药时多加小心
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论12月31日消息 - 环球医学据悉,在两种名称相似的药物由于意外混淆而导致一名患者受“严重伤害”后,美国食品和药物管理局已发布了一项声明,要求医护人员给药时要多加小心。 根据FDA,由于一名药师将去疣体药物Durasal和用于治疗眼科手术后的炎症和疼痛...
-
FDA将采取措施应对医疗器械重复利用导致的感染风险
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论12月30日消息 - 环球医学据悉,一些医疗器械在手术和检查过程中被多次重复使用。这些器械包括外科手术器械(如钳子和镊子)和用于观察身体内部的内窥镜(如支气管镜和结肠镜)。 FDA已收到报告,患者接触到其它患者的微量血液、体液和组织可能会因此导致感染,这是因...
-
Perrigo公司的地氯雷他定片获FDA批准
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论12月30日消息 - 环球医学据悉,Perrigo公司(Nasdaq :PRGO;TASE)宣布,美国食品和药物管理局已最终批准了其地氯雷他定片(5mg)的简化新药申请(ANDA)。Perrigo公司曾因其提交了一个内含Paragraph IV certification专利证言,且此案已于2008年和解。根据和解条...
-
强生公司请求FDA批准拜瑞妥的第三种用途
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论12月30日消息 - 环球医学据悉,强生公司正请求美国批准其抗凝血药拜瑞妥的第三种用途。 该公司的扬森研发所已请求FDA批准此种预防血栓药物用于治疗急性冠脉综合征患者。 拜瑞妥已被批准用于房颤患者。该药物首次获批是在2011年7月,用于预防接受髋关节或膝关节置...
-
美国FDA批准Mylan的甲磺酸依普沙坦片剂的简化新药申请
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论12月29日消息 - 环球医学据悉,Mylan公司(纳斯达克股票代码:MYL)今天宣布,其子公司Mylan制药的400mg和600mg甲磺酸依普沙坦片剂的简化新药申请(ANDA)已获得美国食品和药物管理局(FDA)最终批准。该产品仿制的是雅培公司TEVETEN®片剂,TEVETEN®用于治疗...
-
ThromboGenics公司向FDA提交Ocriplasmin的新药申请
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论12月28日消息 - 环球医学据悉,ThromboGenics公司是一家专门开发创新性眼科用药的生物制药公司,它向美国食品和药物管理局(FDA)提交了一份关于2.5 mg/mL ocriplasmin玻璃体内注射液的生物制品许可申请(BLA),该药用于治疗包括黄斑裂孔在内的有症状的玻璃体粘连(...
-
FDA同意审查吉利德科学公司的抗HIV药物Quad
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论12月28日消息 - 环球医学据悉,吉利德科学公司(纳斯达克股票代码:GILD)近日宣布,美国食品和药物管理局(FDA)已同意审查Quad的新药申请(NDA),Quad是一种完整的单片剂抗HIV药物,内含elvitegravir、cobicistat、恩曲他滨和富马酸替诺福韦酯。 吉利德科学公司于...
-
卫材公司重新向FDA提交吡仑帕奈的新药申请——一种…
环球医学资讯

 1小时0条评论
1小时0条评论12月27日消息 - 环球医学据悉,卫材公司近日宣布,其已于2011年12月22日向美国食品和药物管理局(FDA)重新提交了其研究的AMPA型谷氨酸受体拮抗剂吡仑帕奈的新药申请(NDA);吡仑帕奈用于治疗与癫痫相关的部分性发作。2011年7月FDA向卫材发出拒绝备案函,要求其...
-
FDA因Lap-Band的误导性广告警告多家机构
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论12月13日消息 - 环球医学编译,健康监管部门向为Allergan公司的Lap-Band(一种用于减肥的设备)制作广告时提供误导性信息的8家加利福尼亚的外科中心和一家营销公司发出了警告信。 美国食品药品监督管理局称,这些外科中心和营销公司使用的1-800-GET-THIN LLC广告牌和...
-
FDA向决奈达隆标签中加入新的安全警告
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论12月20日消息 - 环球医学据悉,临床数据显示,抗心律失常药决奈达隆(Multaq,赛诺菲 - 安万特)会增加持续性房颤(AF)患者的严重心血管事件的风险,包括的死亡的风险,据此,FDA要求在此药的标签中加入新的安全警告。 该机构正向该药的标签中添加如下修正和建议...
-
FDA批准百特的ADVATE用于预防A型血友病
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论12月19日消息- 环球医学据悉,百特国际公司今天宣布,美国食品和药物管理局(FDA)已批准ADVATE [抗血友病因子(重组)血浆/白蛋白游离方法]用于常规预防,以防止或减少A型血友病患者出血的频率。ADVATE是美国唯一批准同时用于成人和儿童的预防性抗血友病因子。 此批...
-
FDA修订辛伐他汀与胺碘酮合用时的剂量
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论12月19日消息 - 环球医学据悉,为扭转所谓的错误,美国食品和药物管理局(FDA)昨天宣布,将患者在服用抗心律失常药物胺碘酮的同时,服用辛伐他汀的剂量限值(舒降之,默克公司)恢复至20mg。 在6月,FDA将与胺碘酮、维拉帕米或地尔硫卓同时给药时的辛伐他汀的剂...
-
FDA批准解酒药丸“河豚”
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论12月13日消息 - 环球医学据悉,一种声称能在15分钟内解酒的名叫“河豚”的新型解酒药丸已通过美国食品和药物管理局(FDA)批准。它含有500mg阿司匹林、60mg咖啡因和能舒缓胃部不适的抗酸药。 为了缓解症状,那些遭受宿醉痛苦的人必须服用两片这种水溶性片...
-
FDA极力主张为新一代避孕药加上更强的警告标签
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论12月13日消息 - 环球医学据悉,美国食品和药物管理局的两个顾问委员会建议,FDA应为新一代避孕药加上更强有力的警告标签。 顾问委员会以15比11的投票认为从新药丸中获得的好处大于其风险,但他们表示,目前的标签过于温和,并以21比5的投票认为应在警告标签上显示更...
-
FDA对升血小板药物罗米司亭和艾曲波帕放宽REMS要求
环球医学资讯

 1小时0条评论
1小时0条评论12月12日消息 - 环球医学据悉,美国食品与药品管理局(FDA)于本月6日宣布,对服用、处方或提供罗米司亭(romiplostim,商品名Nplate,安进公司制)或艾曲波帕(eltrombopag,商品名Promacta,葛兰素史克制)的所有人放宽要求,不再要求其进入监控网络。 FDA在发布会...
-
FDA顾问委员会赞成将肺炎疫苗Prevnar 13用于50岁以…
环球医学资讯

 1小时0条评论
1小时0条评论11月18日消息 - 环球医学据悉, 美国食品和药物管理局(FDA)的疫苗与相关生物制品顾问委员会投票赞成将肺炎球菌13价联合疫苗(Prevnar 13,辉瑞公司)的适用范围扩大到50岁以上的成年人。 15人顾问委员会的投票结果是14人赞成1人反对。FDA通常会遵循顾问委...
-
用于2011-2012年流感季节的流感疫苗获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论7月19日消息 - 前沿医学资讯网据悉,美国食品和药物管理局(FDA)7月18日宣布,其已经批准一个三价流感疫苗配方用于2011年至2012年流感季节。 基于FDA疫苗及相关生物制品顾问委员会、世界卫生组织、疾病控制和预防中心和其他已经研究病毒样本和感染模式公众...
-
FDA将快速审评丙肝药物PSI-938
环球医学资讯

 1小时0条评论
1小时0条评论8月25日消息 - 前沿医学资讯网据悉,Pharmasset公司表示,食品和药品管理局已授予其丙型肝炎候选药物PSI-938的快速通道地位。 FDA的决定将允许Pharmasset逐步地提交其上市申请,而不是必须一次全部提交。监管机构也将在6个月内审查该申请,而不是通常的的10...
-
FDA批准IkT-001治疗MS患者JCV感染的2期试验
环球医学资讯

 1小时0条评论
1小时0条评论8月18日消息 - 前沿医学资讯网据国外媒体报道,传染病制药领域的新兴领导者Inhibikase医疗今天宣布,其先导化合物IkT-001的2期概念验证试验的开展已获得FDA批准。IkT-001是一种宿主靶向的激酶抑制剂,旨在清除JC多瘤病毒(JCV)感染,而JCV是进行性多灶性脑白质...
-
FDA批准新的HIV治疗药物利匹韦林
环球医学资讯

 1小时0条评论
1小时0条评论5月24日消息 - 前沿医学资讯网据悉,近日,美国食品和药物管理局(FDA)批准利匹韦林(Rilpivirine,商品名Edurant)与其他抗逆转录病毒药物联用于治疗从未进行过HIV治疗(初治)的HIV-1感染成年患者。Edurant并不能治愈HIV感染,患者必须坚持连续的HIV治疗来控...
-
FDA批准非达霉素用于治疗艰难梭菌感染
环球医学资讯

 1小时0条评论
1小时0条评论5月31日消息 - 前沿医学资讯网据FDA网站报道,美国食品和药物管理局(FDA)近日批准Dificid(通用名非达霉素,Fidaxomicin)片剂用于治疗艰难梭菌相关性腹泻(CDAD)。 两项纳入了564名CDAD患者的试验证明了Dificid的安全性和有效性,试验对Dificid和常用的...
-
FDA近期再次批准另一种丙肝治疗药Incivek
环球医学资讯

 1小时0条评论
1小时0条评论5月26日消息 - 前沿医学资讯网据悉,近日,美国食品和药品管理局(FDA)批准Incivek(Telaprevir)用于治疗某些慢性丙肝感染的成年患者。该药获准与聚乙二醇干扰素α和利巴韦林组成的干扰素疗法联合使用,适用于未接收过以干扰素为主的药物治疗或对之前的治疗应...
-
美FDA批准默克创新口服丙肝治疗药Boceprevir上市
环球医学资讯

 1小时0条评论
1小时0条评论5月18日消息 - 前沿医学资讯网据悉,默克公司日前宣布,美国食品和药品管理局(FDA)批准其慢性丙型肝炎(CHC)治疗创新新药Boceprevir(商品名Victrelis)上市。Victrelis获准与长效干扰素派罗欣(通用名聚乙二醇干扰素α)和利巴韦林联用治疗CHC基因I型慢性丙...
-
首个小针型流感疫苗针剂获美FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论5月13日消息 - 前沿医学资讯网据悉,美国食品和药物管理局(FDA)批准了第一种小针(tiny needle)型流感疫苗针剂(flu shot)的上市申请,该疫苗用小针注射入皮肤细胞内,而不是肌内。 赛诺菲巴斯德公司表示,美国FDA已批准该公司的小针型流感疫苗针剂,即F...
-
基于噬菌体的EcoShield™获美国FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论3月18日消息 - 前沿医学资讯网据悉,Intralytix公司宣布,其有效防止大肠杆菌O157:H7的食品安全产品——基于噬菌体的EcoShield™已经收到美国食品和药物管理局(FDA)监管机构的批准。 批准以一份“食品接触通告”(FCN)的形式出现,其指出红碎肉应有...
-
FDA批准带状疱疹疫苗适用范围纳入50~59岁成人
环球医学资讯

 1小时0条评论
1小时0条评论3月31日消息 - 2011年3月25日,默克公司宣布,美国食品药品管理局(FDA)已经批准扩大Zostavax疫苗(带状疱疹病毒活疫苗)的适用年龄范围,新增了年龄≥50岁的成人。该疫苗用于预防带状疱疹,之前已被批准用于年龄≥60岁的成人。 美国疾病预防控制中心(CDC)目前...
-
FDA批准左氧氟沙星制剂的仿制药
环球医学资讯

 1小时0条评论
1小时0条评论6月22日消息 - 前沿医学资讯网据悉,美国食品和药物管理局称,他们批准了强生公司的抗生素左氧氟沙星制剂的首批仿制药,该药用于治疗细菌感染引起的支气管炎或肺炎。 该抗生素被统称为左氧氟沙星,也治疗皮肤、鼻窦、肾、膀胱和前列腺的感染。监管机构批准了...
-
Truvada(R)和TMC278新药申请再次向FDA提交
环球医学资讯

 1小时0条评论
1小时0条评论2月14日消息 - 前沿医学资讯网据悉,Gilead Sciences公司(纳斯达克交易代码:GILD)近日宣布,其已向美国食品和药物管理局(FDA)相继提交Truvada®(恩曲他滨和替诺福韦disoproxil延胡索酸)单片剂处方和Tibotec制药公司的非核苷逆转录酶抑制剂TMC278(rilp...
-
FDA批准Natroba用于儿童和成人的头虱治疗
环球医学资讯

 1小时0条评论
1小时0条评论1月19日消息 - 前沿医学资讯网据美国食品和药物管理局(FDA)网站报道,其1月18日批准0.9% Natroba(spinosad)外用混悬液用于4岁及以上患者的头虱感染治疗。 FDA药品评价与研究中心药品评价办公室III的主任Julie Beitz博士说,Natroba为头虱感染的典型治疗...
-
格伦马克制药抗疟片剂获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论1月21日消息 - Glenmark(格伦马克)制药表示,美国食品和药物管理局(FDA)已批准其抗疟疾药片阿托伐醌(atovaquone)/盐酸氯胍(proguanil hydrochloride)在美国上市。 据该药品的生产商透漏,其美国子公司Glenmark Generics已收到FDA批准其抗疟疾药片在...
-
美国FDA/CDC调查流感疫苗接种后发热性惊厥增加的原因
环球医学资讯

 1小时0条评论
1小时0条评论1月21日消息 - 前沿医学资讯网据悉,美国食品药物管理局(FDA)1月20日宣布,FDA与美国疾病控制和预防中心(CDC)将调查在接种季节性流感疫苗(Fluzone;Sanofi Pasteur)后热性惊厥儿童人数增加的原因。 该机构指出,几乎所有发热性惊厥儿童能迅速恢复,并且...
-
Teflaro用于治疗细菌感染FDA获批
环球医学资讯

 1小时0条评论
1小时0条评论1月24日消息 -美国食品与药物管理局(FDA)2010年10月29日发布公告,即日起批准Teflaro(活性成分ceftaroline fosamil),一种注射用抗生素,用于治疗成人社区获得性细菌性肺炎(CABP)和急性细菌性皮肤和皮肤结构感染(ABSSSI),包括耐甲氧西林金黄色葡萄球菌...
-
SFDA:敬请关注喹诺酮类药品的不良反应
环球医学资讯

 1小时0条评论
1小时0条评论1月26日消息 -来自国家食品药品监督管理局网站2011年1月20日的消息,国家食品药品监督管理局发布《药品不良反应信息通报》第35期,通报了喹诺酮类药品的不良反应情况。 喹诺酮类药品是临床使用广泛的抗感染药,因其抗菌谱广、疗效显著、使用方便等原因,在...
-
SFDA:喹诺酮类药品的不良反应给予关注
环球医学资讯

 1小时0条评论
1小时0条评论1月24日消息 - 来自国家食品药品监督管理局网站2011年1月20日的消息,国家食品药品监督管理局发布《药品不良反应信息通报》第35期,通报了喹诺酮类药品的不良反应情况。 喹诺酮类药品是临床使用广泛的抗感染药,因其抗菌谱广、疗效显著、使用方便等原因,在...
-
美国FDA修改达芦那韦的推荐剂量
环球医学资讯

 1小时0条评论
1小时0条评论12月17日消息 - 前沿医学资讯网据国外媒体报道,近日,Tibotec Therapeutics公司宣布,对于未携带达芦那韦耐药相关基因突变体(DRV RAMs)的接受过治疗的人类免疫缺陷病毒(HIV - 1)成年患者,美国FDA已批准对达芦那韦片剂与利托那韦联合使用的每日一次推荐剂量的...
-
四环素类抗生素仿制药Doryx获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论12月31日消息 - 前沿医学资讯网据悉,美国的专业制药公司Impax Laboratories日前宣布,美国食品和药物管理局(FDA)已经最终批准了仿制药Doryx(盐酸多西环素缓释剂)75mg和100mg片剂的简化新药申请。 Doryx为四环素类抗生素,用于治疗立克次体感染、性传...
-
SFDA批准肠道病毒71型灭活疫苗进入临床试验
环球医学资讯

 1小时0条评论
1小时0条评论12月29日消息 - 前沿医学资讯网据悉,北京科兴生物制品有限公司于2010年12月28日对外宣布,国家食品药品监督管理局(SFDA)已批准用于预防手足口病的肠道病毒71型(EV71)灭活疫苗进入临床试验。 近几年,我国持续高发手足口病,严重危害儿童的健康和社会安...
-
FDA批准了一种广谱头孢菌素类新药,用于治疗严重的…
环球医学资讯

 1小时0条评论
1小时0条评论11月29日消息 - 2010年10月29日,美国食品药品管理局(FDA)和森林实验室宣布,Teflaro (ceftaroline fosamil)获准用于治疗成人社区获得性细菌性肺炎(CABP)和急性细菌性皮肤和皮肤组织感染(ABSSSI)。 Teflaro是一种注射用头孢菌素类广谱杀菌药。该药适用于治...
-
FDA公告:恢复使用轮状病毒疫苗Rotarix
环球医学资讯

 1小时0条评论
1小时0条评论6月17日消息 - 近日美国FDA发布公告,确认医务工作者可恢复使用轮状病毒疫苗Rotarix以及继续应用RotaTeq。 FDA此前曾建议暂停使用Rotarix疫苗的措施,现在对此建议进行修正,是考虑到这两种疫苗在包括上万名受试者的临床试验和数百万次的临床使用过程中,...
-
FDA通告:假冒达菲含有青霉素样物质
环球医学资讯

 1小时0条评论
1小时0条评论6月23日消息 - 2010年6月17日,美国食品药品管理局(FDA)就网上出售的声称为达菲仿制药的假冒药品发布了一则通告。 FDA开展的试验结果显示,该产品不含有达菲的有效成分奥司他韦,但确实含有氯唑西林,后者为青霉素类抗生素中的一种成分。对青霉素药品过敏的...
-
FDA称尽管轮状病毒疫苗中查出少许猪病毒的DNA 但仍…
环球医学资讯

 1小时0条评论
1小时0条评论5月20日消息 - 2010年5月16日,美国食品药品管理局(FDA)宣布,FDA已完成对近几个月中出现的有关轮状病毒疫苗Rotarix和RotaTeq安全性和使用顾虑的调查工作。FDA现已确定,医生和医护人员可以放心地重新开始使用Rotarix和RotaTeq。 2010年3月22日,FDA推荐暂时...
-
FDA建议暂停使用Rotarix轮状病毒疫苗
环球医学资讯

 1小时0条评论
1小时0条评论3月23日消息 - 美国食品和药物管理局(FDA)建议医疗机构暂停轮状病毒疫苗(Rotarix)在美国的使用,同时该机构正在了解更多关于在疫苗中发现的外来病毒的构成。 现在还没有发现构成安全风险的证据。 欧洲药品监管局(EMEA)也非常关注Rotarix疫苗中意外新出...
-
诺华脑膜炎球菌疫苗Menveo通过FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论2月23日消息 - 诺华制药公司可谓好消息连连,不但脑膜炎球菌疫苗Menveo通过了FDA的批准,多发性硬化症治疗药Gilenia也将得到FDA的优先审批。 Menveo可预防四种常见血清组病毒引起的致命性脑膜炎和脓毒症,适用于11-55岁人群。这次获准的主要依据是药物的一项...
-
美FDA发布警告:抗HIV药因服雷和Norvir联用可导致心…
环球医学资讯

 1小时0条评论
1小时0条评论2月25日消息 - 2010年2月23日,美国食品药品管理局(FDA)发布警告,提醒联用因服雷(沙奎那韦)和Norvir(利托那韦)可能会对心脏产生严重不良影响。因服雷和Norvir是联合用于治疗人类免疫缺陷病毒(HIV)感染的抗病毒药。 处于审查中的该研究数据由因服雷生产商...
-
FDA批准辉瑞肺炎球菌疫苗Prevnar 13
环球医学资讯

 1小时0条评论
1小时0条评论2月26日消息 - 辉瑞产品Prevnar 13已获FDA批准,其用于儿童免疫接种,预防由13种血清型肺炎链球菌感染引起的侵入性疾病和中耳炎。该疫苗是明星药婴幼儿用Prevnar疫苗的最新一代产品,辉瑞通过收购惠氏而相应得到了该疫苗的许可权。 本次Prevnar 13获批的依据...
-
片剂型抗HIV药Norvir获得FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论2月22日消息 - 10日,美国食品药品管理局(FDA)宣布批准Norvir (利托那韦) 片剂剂型。Norvir的适应证为人类免疫缺陷病毒感染,此前上市的剂型包括软胶囊剂型和口服液剂型。 与胶囊剂型不同,这一最新的Norvir 100mg片剂剂型不需要冷冻保存。但是,服用片剂剂...
-
FDA专家组建议将大流行性H1N1菌株用于2010~2011年的…
环球医学资讯

 1小时0条评论
1小时0条评论2月24日消息 - 2月22日,美国食品药品管理局(FDA)顾问专家组建议:美国针对2010~2011年流感季节的流感疫苗应含有大流行性甲型流感(H1N1)菌株,以此代替现用疫苗所含2种季节性甲型流感菌株中的1种。 在FDA疫苗及相关生物制品顾问委员会召开的一次会议上,专家...
-
FDA与PAHT合作促进研发预防儿童肺炎球菌性疾病的疫苗
环球医学资讯

 1小时0条评论
1小时0条评论3月14日消息 - 美国食品药品管理局(FDA)近期发布了将与PATH(美国帕斯适宜卫生科技组织)合作促进研发用于预防儿童感染肺炎链球菌(肺炎球菌)疫苗的通告。此次合作的目的在于改进研制技术,促进和帮助发展中国家生产安全、有效和低价的疫苗产品,以预防儿童肺...
-
美国FDA批准NeurogesX疱疹止痛贴Qutenza上市
环球医学资讯

 1小时0条评论
1小时0条评论<?xml:namespace prefix = st1 ns = "urn:schemas-microsoft-com:office:smarttags" />11月18日消息 – NeurogesX公司于16日表示美国FDA已经批准其带状疱疹止痛贴Qutenza(capsaicin)上市销售。<?xml:namespace prefix = o ns = "urn:schemas-microsoft-com:offic...
-
FDA批准第五个2009H1N1流感疫苗上市
环球医学资讯

 1小时0条评论
1小时0条评论<?xml:namespace prefix = st1 ns = "urn:schemas-microsoft-com:office:smarttags" />11月20日消息 – 美国食品药品监督管理局(FDA)于11月16日批准第五个2009H1N1流感疫苗上市。与另外四个已经获批(FDA 9月15日批准)的H1N1流感疫苗相同,制药公司将在经过批准...
-
FDA认为头孢吡肟无死亡率增加风险
环球医学资讯

 1小时0条评论
1小时0条评论11月19日消息 - 近日,美国食品药品管理局(FDA)向医护人员发布安全信息,通告对头孢吡肟导致死亡率增加的潜在风险的相关评估结果。FDA对数据进行了荟萃分析(meta-analysis)后得出,与其他同类药物相比,在接受头孢吡肟治疗的患者中并未发现死亡率的显著增加...
-
FDA:合用沙奎那韦和利托那韦可致致命心律异常
环球医学资讯

 1小时0条评论
1小时0条评论10月25日消息 - 美国食品和药物管理局(FDA)21日发表声明称,联合使用两种艾滋病治疗药物——罗氏公司出品的沙奎那韦和雅培公司生产的利托那韦,可能引发致命的心脏异常,该局已要求在这两种药的产品标签上添加警告。 声明说,经常联合使用这两种药可以导...
-
美国FDA批准4种抗H1N1病毒疫苗
环球医学资讯

 1小时0条评论
1小时0条评论9月17日消息 - 美国食品药品管理局(FDA)已批准4家生产商生产抗甲型H1N1流感病毒疫苗。 批准通知于9月15日发布。在美国政府许可的5家生产季节性流感疫苗的药商中,有4家获得批准:CSL Ltd.、阿斯利康旗下MedImmune公司、诺华疫苗和诊断公司和赛诺菲巴斯德公...
-
FDA推迟对II型糖尿病在研治疗药阿洛利停的审查
环球医学资讯

 1小时0条评论
1小时0条评论11月23日消息 -环球医学据悉,武田制药公司及其美国全资子公司武田全球研发中心宣布,该公司收到美国食品及药品管理局(FDA)的通知,称将延迟对其在研II型糖尿病治疗药阿洛利停(NESINA,通用名苯甲酸阿格列汀,Alogliptin Benzoate)及固定剂量的阿洛利停/匹格...
-
FDA 批准艾塞那肽作为甘精胰岛素的辅助药物
环球医学资讯

 1小时0条评论
1小时0条评论10月26日消息 - 环球医学据悉,研究机构上周公布,艾塞那肽注射液(Byetta Amylin制药公司和礼来公司)获美国食品和药品监督管理局批准作为甘精胰岛素辅助治疗用药,甘精胰岛素主要用于单纯依靠胰岛素类似物不能达到足够的血糖控制的2型糖尿病患者。 艾塞那...
-
FDA决定推迟对Dapagliflozin的审评决定
环球医学资讯

 1小时0条评论
1小时0条评论10月31日消息 - 环球医学据悉,施贵宝和阿斯利康宣布,美国食品和药品管理局(FDA)已将针对dapagliflozin治疗2型糖尿病审评的决定日期推迟三个月。 Dapagliflozin是一种肾脏SGLT2靶标的抑制剂,并正处于阿斯利康和施贵宝的联合研究之中。Dapagliflozin正在研...
-
诺和诺德向FDA申请批准Victoza与长效胰岛素同时使用
环球医学资讯

 1小时0条评论
1小时0条评论6月29日消息 - 前沿医学资讯网据悉,丹麦制药公司诺和诺德公司正在向美国申请批准其糖尿病药物Victoza(利拉鲁肽注射液,rDNA来源)与长效胰岛素联合使用。 本周二,发言人Mike Rulis拒绝透露诺和诺德公司预计的审查过程需要多久。 Victoza每日一次注射...
-
武田对FDA关于糖尿病治疗药吡格列酮的警告做出回应
环球医学资讯

 1小时0条评论
1小时0条评论6月17日消息 - 前沿医学资讯网据悉,继美FDA对糖尿病药物Actos发出警告后,武田制药公司表示,他们对ACTOS的治疗获益有信心,对于2型糖尿病患者该治疗非常重要。该公司还表示,其将仍致力于ACTOS和包含ACTOS的药物,和致力于数百万患有糖尿病的患者。 武田正...
-
美FDA警告糖尿病治疗药liraglutide可引起严重风险
环球医学资讯

 1小时0条评论
1小时0条评论6月15日消息 - 前沿医学资讯网据Medccape报道,美国时间6月13日,美食品和药物管理局(FDA)警告说,因liraglutide注射剂(Victoza, 诺和诺德)可增加甲状腺C细胞瘤和急性胰腺炎的风险,专业医护人员应密切监测接受liraglutide治疗的糖尿病患者。 诺和诺德公...
-
FDA:文迪雅将于11月全面下架
环球医学资讯

 1小时0条评论
1小时0条评论5月23日消息 - 据健康报报道,美国食品和药物管理局(FDA)已于18日宣布,决定从今年11月起全面下架因安全问题备受争议的降糖药文迪雅。 FDA发表声明说,该下架法令将从今年11月18日起生效,届时文迪雅将从美国的零售药店全面退出,其生产商英国葛兰素史克公司...
-
FDA限制使用含罗格列酮的糖尿病治疗药
环球医学资讯

 1小时0条评论
1小时0条评论5月25日消息 - 2011年5月18日,美国食品药品管理局(FDA)宣布对含罗格列酮药物的处方和应用施加新的限制条件。这类药物用于治疗2型糖尿病,以商品名“文迪雅”、“文达敏”和“文达锐”出售。 风险评估与降低策略(REMS)是FDA的一项用于帮助管理与使用市售药物...
-
FDA专家小组在支持批准Contrave的同时也继续呼吁修…
环球医学资讯

 1小时0条评论
1小时0条评论12月16日消息 - 在顾问委员会针对Orexigen开发的减肥药Contrave所召开的评审会议上,FDA透露其正准备修改减肥药指南草案,尤其是要对有关心血管风险管理目标的内容进行修改。不过,FDA也强调目前已进入评审程序的药物将继续采用草案所规定的标准进行评判。 ...
-
FDA仍在评估甘精胰岛素与癌症风险的相关性
环球医学资讯

 1小时0条评论
1小时0条评论1月14日消息 - 前沿医学资讯网据悉,一些研究表明,甘精胰岛素的使用(甘精胰岛素注射剂,赛诺菲安万特)可能与癌症风险增加有关,但现有的证据尚无法定论。在更新的安全公告中,美国食品和药物管理局(FDA)1月13日表示,他们的审查工作正在进行之中,并未得出...
-
FDA拒绝竞技场减肥药lorcaserin上市
环球医学资讯

 1小时0条评论
1小时0条评论10月26日消息 - 前沿医学资讯网据国外媒体报道,近日竞技场制药公司宣布,美国食品和药物管理局拒绝了lorcaserin的上市申请,竞技场试图使lorcaserin成为十多年来首个FDA批准的新的处方减肥药。 9月16日,FDA专家小组以9-5的投票结果反对批准lorcaserin上市...
-
SFDA对罗格列酮及其复方制剂说明书的修订要求
环球医学资讯

 1小时0条评论
1小时0条评论10月19日消息 - 近期,国家食品药品监管局及时组织相关专家对罗格列酮及其复方制剂在我国临床使用的安全性进行了评估。为保证公众用药安全,日前,国家食品药品监管局和卫生部决定加强罗格列酮及其复方制剂的使用管理,要求各级药品监管部门、卫生行政部门立即将...
-
FDA允许治疗糖尿病药物文迪雅继续上市
环球医学资讯

 1小时0条评论
1小时0条评论9月27日消息 - 2010年9月23日,美国食品药品管理局(FDA)宣布,糖尿病药物文迪雅 (Avandia,罗格列酮)可继续上市,用于使用其他治疗糖尿病药物无法完全控制血糖的2型糖尿病患者。该药最近因心血管安全性方面的担忧而接受了严格审查。 一份由FDA药物评价和研究...
-
双膦酸盐:FDA考虑修改产品标签
环球医学资讯

 1小时0条评论
1小时0条评论图 文献中报告过的接受双膦酸盐治疗患者转子下部位发生应力反应直至骨折的一系列X线片 9月27日消息 - 双膦酸盐是广泛使用的能有效降低骨质疏松患者常见骨折危险的一类药物。然而上周美国骨矿物质研究学会(ASBMR)组织的专家特别工作组发布报告称,长期...
-
FDA调查糖尿病药物Actos膀胱癌风险
环球医学资讯

 1小时0条评论
1小时0条评论9月26日消息 - 2010年9月17日,美国食品药品管理局(FDA)宣布对Actos(吡格列酮)的安全性进行审查,以确定服用该药物是否与提高膀胱癌风险有关。FDA决定启动该审查是因为动物和人体研究显示可能存在该安全性风险。 Actos于1999年获得FDA批准,用于帮助成人II型...
-
罗格列酮:FDA限制使用,EMEA终止使用
环球医学资讯

 1小时0条评论
1小时0条评论9月25日消息 - 前沿医学资讯网据DocGuide9月23日报道,美国FDA宣布,它将大大限制罗格列酮(文迪雅)用于治疗2型糖尿病患者,这些患者服用其它药物不能很好控制糖尿病。 这一新的限制是基于研究数据,这些研究表明接受罗格列酮治疗的患者心血管疾病风险升高,...
-
FDA正对吡格列酮的潜在膀胱癌危险进行评估
环球医学资讯

 1小时0条评论
1小时0条评论9月21日消息 - 9月17日FDA公告指出,美国FDA正在对一项进行中的评价吡格列酮(商品名:艾可拓)是否与膀胱癌危险升高有关的10年流行病学研究进行评审。有研究提示吡格列酮在动物和人体中有潜在的安全性危险,需要进一步研究。 吡格列酮可用于在饮食和锻炼的...
-
减肥药Lorcaserin未通过FDA专家组认证
环球医学资讯

 1小时0条评论
1小时0条评论9月21日消息 - 9月16日,美国FDA专家组以5票赞成、9票反对拒绝签署减肥药Lorcaserin的批准申请。该投票由FDA内分泌和代谢药物顾问委员会进行。 这一新型5羟色胺2C(5HT2c)受体拮抗剂希望作为饮食和锻炼的附加措施,治疗体质指数≥30 kg/m2的肥胖者,或体质...
-
FDA审查有关糖尿病药物文迪雅心血管风险的最新资料 …
环球医学资讯

 1小时0条评论
1小时0条评论2月25日消息 - 2010年2月22日,美国食品药品管理局(FDA)宣布,其正对一项大规模长期临床研究(罗格列酮治疗糖尿病的心血管转归和血糖调节评价研究,RECORD)的初步数据进行审查,以分析与使用糖尿病治疗药物文迪雅(罗格列酮)相关的潜在心血管风险。此外,FDA一直在...
-
FDA批准每日一次美沙拉嗪用于维持溃疡性结肠炎缓解
环球医学资讯

 1小时0条评论
1小时0条评论7月19日消息 - 前沿医学资讯网据Medscape报道,Shire公司7月18日宣布,美国食品和药物管理局(FDA)已经批准缓释美沙拉嗪制剂(Lialda)用于维持溃疡性结肠炎患者的缓解状态。 该药物已经批准用于活动性、轻度至中度溃疡性结肠炎患者诱导缓解。 Shire胃...
-
FDA批准英利昔单抗用于治疗6岁以上儿童溃疡性结肠炎…
环球医学资讯

 1小时0条评论
1小时0条评论9月23日消息 - 前沿医学资讯网据悉,近日,美国食品和药物管理局批准类克(英利昔单抗)用于治疗6岁以上儿童的中度至重度活动期溃疡性结肠炎(UC),这些儿童对常规治疗应答不足。 类克可减轻UC的症状和体征,并且能诱导和维持这些患者的临床缓解状态。 ...
-
FDA批准注射用凝胶Solesta治疗大便失禁
环球医学资讯

 1小时0条评论
1小时0条评论5月30日消息 - 前沿医学资讯网据悉,美国食品和药物管理局(FDA)近日批准无菌注射用凝胶Solesta用于治疗对其他治疗(如饮食改变,纤维素治疗或抗运动药物)失败的大便失禁患者。 大便失禁是一种非随意的肠道控制缺失。引起大便失禁原因有多种,包括神经损伤...
-
FDA关注抗丙肝治疗药Boceprevir的安全性问题
环球医学资讯

 1小时0条评论
1小时0条评论4月28日消息 - 前沿医学资讯网据悉,美国药物评论员在周一发布的文件中强调了默克公司的抗肝炎试验药物Boceprevir的安全性问题,包括贫血及有关精神病问题的报告。 美国食品和药物管理局(FDA)顾问委员会在周三的公开会议上对药物Boceprevir作出评论。FDA工...
-
礼来胰腺酶替代治疗新药Liprotamase遭美国FDA拒批
环球医学资讯

 1小时0条评论
1小时0条评论4月20日消息 - 前沿医学资讯网据悉,美国礼来公司已收到美国食品和药品管理局(FDA)对其Liprotamase新药申请的一封完整的回复函,函中要求礼来公司在再次提交申请之前开展额外的临床试验。 Liprotamase是一种非猪胰腺酶替代疗法(PERT),正在研究用于治疗...
-
FDA对默克公司丙肝治疗药物Boceprevir给予积极评价
环球医学资讯

 1小时0条评论
1小时0条评论4月27日消息 - 前沿医学资讯网据悉,美国食品与药品管理局(FDA)近日公布了对默克公司生产的丙肝治疗药物Boceprevir的审查意见,据联邦卫生官员称,受到高度关注用于治疗丙肝的此种药物显示了不错的疗效,与已使用20年的抗丙肝药物相比,可在更短的治疗时间内治...
-
首个早期鉴别诺如病毒的检验上市FDA获批
环球医学资讯

 1小时0条评论
1小时0条评论2月25日消息 - 近日美国食品与药物管理局(FDA)发布公告,准许首个早期鉴别诺如病毒(norovirus)的检验上市。该检验有助于识别并制止诺如病毒疫情的爆发。 在美国,诺如病毒是食源性疾病暴发的主要原因。Ridascreen诺如病毒第三代酶联免疫(EIA)法是在许...
-
FDA批准HPV疫苗用于预防直肠癌
环球医学资讯

 1小时0条评论
1小时0条评论12月24日消息 - 前沿医学资讯网据docguide报道,美国食品和药物管理局(FDA)已经批准HPV疫苗(Gardasil)用于预防年龄在9-26岁人群因人乳头状瘤病毒(HPV)6/11/16/18型引起的直肠癌和相关癌前病变。 FDA生物制品评估和研究中心的Karen Midthun博士说,直肠...
-
FDA称,止吐药Anzemet注射剂禁用于化疗引起的恶心和…
环球医学资讯

 1小时0条评论
1小时0条评论12月24日消息 - 2010年12月17日,美国食品药品管理局(FDA)发布了一则通告,声明不应该再将Anzemet(甲磺酸多拉司琼)注射剂用于预防小儿和成人患者由于癌症化疗引起的恶心和呕吐(CINV)。FDA已经确定使用该产品可能会通过延长QT间期、QRS间期和PR间期进而影响心脏电...
-
腹泻型肠易激综合症治疗药MuDelta获FDA快速通道资格
环球医学资讯

 1小时0条评论
1小时0条评论1月25日消息 - 前沿医学资讯网据THE MEDICAL NEWS网站报道,Furiex制药公司(纳斯达克:FURX)近日宣布,其新型腹泻型肠易激综合症治疗药MuDelta已获得美国食品和药物管理局(FDA)快速通道资格,目前该药的2期临床试验正在进行。 FDA的快速通道方案指定用于...
-
FDA警告:质子泵抑制剂有骨折风险
环球医学资讯

 1小时0条评论
1小时0条评论5月28日消息 - 美国食品药品管理局(FDA)在5月25日向医生和消费者发布了一则警告,内容为质子泵抑制剂可能会增加髋骨、腕骨及脊柱骨折的风险。 FDA称其正在更改质子泵抑制剂(PPI)的处方和非处方版说明书,使之能反映新的安全信息,即FDA对7项流行病学研究进行...
-
FDA敦促肝病患者慎用血小板减少症治疗药Promacta
环球医学资讯

 1小时0条评论
1小时0条评论5月20日消息 - 2010年5月12日,美国食品药品管理局(FDA)联合葛兰素史克公司(GSK)发布了一则有关一项新安全性结果的通告,此结果出现在一项以促血小板生成素受体激动剂Promacta (艾曲波帕)治疗患者的研究中。 在对伴发慢性肝病(多种病因所致)的血小板减少症患...
-
胰酶产品Pancreaze获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论4月21日消息 - 前沿医药资讯网从FDA网站获悉,美国食品和药物管理局(FDA)4月12日批准胰酶产品(PEP)Pancreaze缓释胶囊。这是第三个同类产品获得美国FDA批准。 胰酶产品改善体内不能产生足够胰腺酶患者的食物消化。这些患者包括:囊性纤维化、慢性胰腺炎、...
-
FDA:抗生素类药物Xifaxan获准用于预防肝性脑病复发
环球医学资讯

 1小时0条评论
1小时0条评论3月30 日消息 - 据国外的媒体报道,2010年3月24日,美国食品药品管理局(FDA)已批准Xifaxan(利福昔明) 用于晚期肝病患者的治疗,降低其显性肝性脑病(HE)复发风险。 Xifaxan的批准是基于一项随机安慰剂对照临床试验的研究结果。该实验证实了Xifaxan预防HE的有...
-
FDA发布关于Maalox产品的警告
环球医学资讯

 1小时0条评论
1小时0条评论2月24日消息 - 2010年2月17日,美国食品药品管理局(FDA)发布警告,称如果将Maalox Total Relief误认为其他Maalox产品而服用,则可能导致出现严重不良反应。这些产品并不能互换。 Maalox Total Relief含有次水杨酸铋,适用于治疗胃部不适和腹泻,而传统Maalox...
-
SFDA修订奥利司他制剂和镇定催眠药说明书
环球医学资讯

 1小时0条评论
1小时0条评论9月19日消息 - 为控制药品使用风险,国家食品药品监督管理局决定对奥利司他制剂和镇定催眠药说明书进行修订。 在新修订的奥利司他制剂说明书【不良反应】项中,更新为“使用奥利司他已有罕见的转氨酶升高、碱性磷酸酶升高和重度肝炎的报告,并出现肝衰竭病...
-
甲氧氯普胺速溶片剂获美国FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论9月16日消息 - Salix 制药公司在2009年9月8日宣布:5mg 和 10mg Metozolv ODT(盐酸甲氧氯普胺口服崩解片)已获美国食品药品管理局(FDA)的上市批准。Metozolv ODT获...
-
FDA撤销阿瓦斯汀用于治疗乳腺癌患者的许可
环球医学资讯

 1小时0条评论
1小时0条评论11月21日消息 - 美国食品及药物管理局(FDA)局长Margaret A. Hamburg博士于本月18日称,她认定阿瓦斯汀(Avastin,通用名贝伐单抗,bevacizumab)对乳腺癌用途并不是安全有效的,所以她撤销了FDA对该药用于乳腺癌适应症的批准。 阿瓦斯汀将仍在市场有售,用...
-
FDA批准舒尼替尼用于罕见进展性胰腺神经内分泌癌
环球医学资讯

 1小时0条评论
1小时0条评论5月24日消息 - 前沿医学资讯网据悉,美国食品和药物管理局近日批准舒尼替尼(Sunitinib,商品名索坦Sutent)用于治疗不能手术切除肿瘤或肿瘤已扩散至身体的其他部位(转移性)的进展性胰腺神经内分泌癌患者。 这是第二个新获FDA批准用于治疗此种疾病的药物...
-
ZIN ATI-001治疗黑色素瘤的临床研究申请获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论6月13日消息 - 前沿医学资讯网据News-Medical.Net报道,ZIOPHARM肿瘤公司(纳斯达克:ZIOP)近日宣布,美国食品与药物管理局(FDA)已接受了该公司的开始ZIN ATI-001临床研究的新药临床研究申请(IND)。ZIN ATI-001是一种用于黑色素瘤的新型DNA治疗候选药,又称...
-
安进公司向FDA申请骨治疗药Xgeva新的适应症
环球医学资讯

 1小时0条评论
1小时0条评论6月30日消息 - 前沿医学资讯网据悉,安进公司已向美国食品和药物管理局申请,扩大其骨治疗药Xgeva的使用范围,用于防止或延缓晚期前列腺癌的扩散。如果获得批准,Xgeva将是首个获批用于防止或延缓癌细胞扩散到骨组织的治疗药物。 此次申请的递交是基于一项重...
-
FDA:脑肿瘤治疗新器械批准
环球医学资讯

 1小时0条评论
1小时0条评论4月19日消息 -近日美国食品与药物管理局(FDA)发布公告,批准NovoTTF-100A系统用于治疗化疗和放疗后复发或进展的成人多形性胶质母细胞瘤(GBM)。 脑肿瘤是脑组织异常细胞的生长。据美国国立癌症研究所数据,美国每年大约有19000例患者被诊断为原发性脑肿...
-
FDA指定BioSante黑色素瘤疫苗为孤儿药
环球医学资讯

 1小时0条评论
1小时0条评论1月27日消息 - 前沿医学资讯网据THE MEDICAL NEWS网站报道,BioSante制药公司(NASDAQ:BPAX)近日宣布,FDA的孤儿产品开发办公室将其黑色素瘤疫苗指定为孤儿药,用于治疗IIb – IV期黑色素瘤。 黑色素瘤是一种最致命的皮肤癌。孤儿药法案针对影响少于20万人...
-
FDA警告乳房假体可能与罕见肿瘤有关
环球医学资讯

 1小时0条评论
1小时0条评论1月30日消息 - 1月26日,美国食品药品管理局(FDA)在其官网发表《间变性大细胞淋巴瘤与乳房假体:FDA的初步发现与分析》(Anaplastic Large Cell Lymphoma (ALCL) in Women with Breast Implants: Preliminary FDA Findings and Analyses),该文对1997~2010年间发...
-
美国FDA欲取消阿瓦斯丁的乳腺癌指征
环球医学资讯

 1小时0条评论
1小时0条评论12月17日消息 - 前沿医学资讯网据美国食品和药物管理局(FDA)官方网站报道,其于当地时间12月16日宣布,建议从阿瓦斯丁(Avastin,贝伐单抗)的标签中去除乳腺癌指征,因为没有证据表明该药物对乳腺癌安全有效。 FDA是在审查了四项关于阿瓦斯汀治疗乳腺癌妇...
-
首个治疗先天性凝血因子XIII缺乏症制剂获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论2月22日消息 -美国食品与药物管理局(FDA)发布公告,批准Corifact用于预防先天性凝血因子XIII缺乏症患者的出血症。 先天性凝血因子XIII缺乏症是一种罕见的基因缺陷病。Corifact是首个被FDA批准用于治疗该病的制剂。 凝血因子XIII是一种存在于血液循环并...
-
美国FDA批准细胞免疫疗法用于治疗晚期前列腺癌
环球医学资讯

 1小时0条评论
1小时0条评论4月30日消息 - 前沿医药资讯网据国外媒体报道,美国食品和药物管理局(FDA)于4月29日批准sipuleucel - T(Provenge)用于治疗特定晚期前列腺癌患者,Provenge是一种利用患者自身的免疫系统抗击疾病的新疗法。 Provenge主要用来治疗癌细胞已扩散到身体的其他...
-
美国FDA就其在FDA专家组反对批准厄洛替尼后批准该药…
环球医学资讯

 1小时0条评论
1小时0条评论4月26日消息 - 美国食品药品管理局(FDA)为何不顾其顾问专家组的反对而执意批准厄洛替尼片(特罗凯)用作局部晚期或转移期非小细胞肺癌(NSCLC)的维持治疗药物? 据FDA药物评估中心肿瘤药品部主任Robert Justice博士称,监管先例、试验设计、缺少相对有效性标准...
-
基因泰克公司向FDA提交赫赛汀扩大使用范围申请
环球医学资讯

 1小时0条评论
1小时0条评论4月26日消息 - 前沿医药资讯网据国外媒体报道,罗氏集团属下的基因泰克公司宣布,该公司向美国食品和药物管理局(FDA)提交了生物制品许可补充申请,申请赫赛汀(曲妥珠单抗)联合化疗用于治疗晚期HER2阳性胃腺癌患者,包括胃交界癌。 该项申请是基于一项名...
-
雄激素阻断药Trelstar的新型长效制剂获得FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论3月24日消息 - 11日,华生制药公司宣布,美国食品药品管理局(FDA)批准了Trelstar(双羟萘酸曲普瑞林)的一种新剂型,该药用于晚期前列腺癌的姑息治疗。这种新剂型是一种含有22.5 mg活性成分(促性腺激素释放激素激动剂)的混悬液,其给药途径为肌注,2次/年。时至今...
-
FDA顾问表示:阿瓦斯丁(Avastin)不应该用于乳腺癌…
环球医学资讯

 1小时0条评论
1小时0条评论7月22日消息 - 前沿医学资讯网据国外媒体报道,美国FDA顾问专家小组于20日投票表示,抗癌药物阿瓦斯丁(Avastin)不应再被用于乳腺癌治疗,该药物没有使患者受益。 12:1的投票使阿瓦斯丁受挫。Avastin是世界上最畅销的抗癌药物,销售额去年约为60亿美元。Av...
-
FDA延期审批Tarceva治疗晚期非小细胞肺癌
环球医学资讯

 1小时0条评论
1小时0条评论1月19日消息 - FDA近日表示,将延期90天审批Tarceva作为肺癌一线治疗药的申请。这份补充新药申请由罗氏基因泰克和OSI两家制药公司递交,目的是希望它可作为一线药物治疗晚期非小细胞肺癌。OSI已就此递交了另一份补充性数据。 最新递交的数据是在一项889名患...
-
FDA批准氟维司群新剂量用于治疗HR+转移性乳腺癌绝经…
环球医学资讯

 1小时0条评论
1小时0条评论9月13日消息 - 前沿医学资讯网据docguide报道,美国食品及药物管理局(FDA)新批准的500mg剂量的氟维司群(FASLODEX注射药),取代了先前批准过的250mg剂量的氟维司群,用于治疗激素受体阳性的乳腺癌转移绝经后妇女,这些妇女在抗雌激素治疗后疾病继续进展。 5...
-
美FDA批准Votrient用于治疗晚期肾细胞癌
环球医学资讯

 1小时0条评论
1小时0条评论10月21日消息 - 美国FDA10月19日批准葛兰素史克生产的Votrient(Pazopanib)药物,Votrient为自2005年以来FDA批准的第6个治疗肾细胞癌的药物。 Votrient是一种新型口服血管抑制药,它通过干扰实体瘤生长和生存所需要的新生血管的发生而达到抗癌的目的。 ...
-
美FDA批准Votrient用于治疗晚期肾细胞癌
环球医学资讯

 1小时0条评论
1小时0条评论10月21日消息 - 美国FDA10月19日批准葛兰素史克生产的Votrient为治疗晚期肾细胞癌的新型药物,Votrient为自2005年以来FDA批准的第6个治疗肾细胞癌的药物。 Votrient是一种新型口服血管抑制药,它通过干扰实体瘤生长和生存所需要的新生血管的发生而达到抗癌的...
-
FDA对含有氯氟碳类的哮喘气雾吸入剂下达禁令
环球医学资讯

 1小时0条评论
1小时0条评论9月24日消息 - 前沿医学资讯网据悉,美国食品与药品管理局确认将继续禁止含有氯氟碳类(CFCs)的哮喘气雾吸入剂的使用,因此类吸入剂对环境有害。 该卫生机构在2008年时已允诺将逐步淘汰此类吸入剂,且现已透露该禁令将于明年起生效。这一决定意味着唯一的非...
-
FDA批准治疗晚期非小细胞肺癌的新药
环球医学资讯

 1小时0条评论
1小时0条评论8月29日消息 - 前沿医学资讯网据悉,美国食品和药物管理局(FDA)已经批准crizotinib用于治疗表达异常的间变性淋巴瘤激酶(ALK)基因的晚期非小细胞肺癌(NSCLC)患者。 对于ALK基因重排的患者,crizotinib显示出了显著的活性,并可延长生存期。在约4%~5%...
-
儿童误服和过量服用处方镇咳药苯佐那酯促使FDA发出…
环球医学资讯

 1小时0条评论
1小时0条评论12月17日消息 - 2010年12月14日,美国食品药品管理局(FDA)发布一则警告,提醒公众,10岁以下的儿童误服苯佐那酯可能会导致药物过量和继发死亡。苯佐那酯以商品名“Tessalon”出售,还以非专利药出售。本药是一种获准用于缓解10岁以上儿童咳嗽症状的处方药。 ...
-
辉瑞向FDA和EMA提交肺炎球菌13价结合疫苗申请
环球医学资讯

 1小时0条评论
1小时0条评论12月28日消息 - 前沿医学资讯网近日,辉瑞公司向美国FDA和欧盟EMA提交了扩大Prevnar13(肺炎球菌13价结合疫苗)接种范围的补充申请。该疫苗扩大用于50岁及以上人群预防由疫苗中13血清型肺炎球菌引起的疾病。 从申请提交日期开始到FDA受理申请,FDA将进行为期...
-
SFDA批准易瑞沙一线治疗晚期非小细胞肺癌患者
环球医学资讯

 1小时0条评论
1小时0条评论12月29日消息 - 前沿医学资讯网据悉,近日,阿斯利康研发的癌症治疗药易瑞沙(吉非替尼片)获国家食品药品监督管理局(SFDA)正式批准,用于一线治疗局部晚期、转移性非小细胞肺癌患者。 阿斯利康中国区负责人透露,易瑞沙是在中国上市的首个肺癌治疗分...
-
FDA警告哮喘药特布他林不要用于早产的预防和治疗
环球医学资讯

 1小时0条评论
1小时0条评论2月18日消息 - 前沿医学资讯网据悉,美国食品和药物管理局(FDA)警告,通过注射或输液泵使用的特布他林不应该用于怀孕妇女早产的预防或延长(超过48-72小时)治疗,鉴于其潜在导致孕妇严重心脏问题和死亡风险。FDA在该药的处方信息(标签)上添加黑框警告和禁忌...
-
新型黑色素瘤DNA治疗药的临床研究申请已提交FDA
环球医学资讯

 1小时0条评论
1小时0条评论5月19日消息 - 前沿医学资讯网据悉,日前,Ziopharm肿瘤制药公司(Ziopharm Oncology, Inc.)向美国食品和药物管理局(FDA)提交了Ad-RTS-IL-12(INXN 2001/1001)试验性新药(IND)临床研究申请。该药是一种用于黑色素瘤的新型DNA治疗候选产品,它是建立合成生...
-
复方雾化吸入剂Dulera用于治疗哮喘获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论6月29日消息 - 2010年6月24日,默克公司宣布,美国食品药品管理局(FDA)已批准Dulera用于治疗12岁及12岁以上的哮喘患者。Dulera是一种含有皮质类固醇(糠酸莫米松)与长效β2受体激动剂(LABA)(富马酸福莫特罗)的雾化吸入剂。 Dulera作为处方药,仅用于经长期平...
-
Gilead产品Cayston吸入溶液获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论2月24日消息 - 由Gilead制药公司研制的Cayston(氨曲南吸入溶液)已获FDA批准,用于缓解由绿脓杆菌感染引致囊肿性纤维化(CF)患者的呼吸症状。 Cayston将于下周末开始进入美国市场销售。其在欧盟、加拿大和澳大利亚的销售申请已获准,在瑞士和土耳其的销售...
-
FDA出台新措施以促进哮喘治疗中安全使用长效β受体…
环球医学资讯

 1小时0条评论
1小时0条评论2月24日消息 - 美国食品药品管理局(FDA)于2010年2月18日发布了一项安全使用长效β受体激动剂(LABA)相关促进措施的公告,此类药物可用于治疗哮喘和慢性阻塞性肺病。FDA在对多项研究结果进行分析后才出台该举措,这些研究结果表明,使用LABA与哮喘病情严重恶化风险...
-
美国FDA起草了H1N1大流行期间血液制品及献血指南
环球医学资讯

 1小时0条评论
1小时0条评论11月18日消息 - 为应对大流行性甲型H1N1流感病毒的出现,美国食品药品管理局(FDA)制定了有助于保持血液制品安全性的建议草案。该草案于11月13日在线发布。 这些建议由FDA生物制品评价与研究中心(Center for Biologics Evaluation and Research)提出,针对...
-
美国FDA起草了H1N1大流行期间血液制品及献血指南
环球医学资讯

 1小时0条评论
1小时0条评论11月18日消息 - 为应对大流行性甲型H1N1流感病毒的出现,美国食品药品管理局(FDA)制定了有助于保持血液制品安全性的建议草案。该草案于11月13日在线发布。 这些建议由FDA生物制品评价与研究中心(Center for Biologics Evaluation and Research)提出,针对...
-
葛兰素史克公司和FDA警告不要雾化吸入依乐韦
环球医学资讯

 1小时0条评论
1小时0条评论2009年10月16日消息 - 10月9日,美国食品药品管理局(FDA)和葛兰素史克公司向医护人员发出警示,通告一名流感病人因通过机械通气吸入雾化溶解的依乐韦(扎那米韦)吸入粉雾剂而导致死亡。葛兰素史克公司强调,依乐韦吸入粉雾剂不适合用任何液态剂型溶解,不建议用于...
-
FDA和EMA更新信息:决奈达隆使死亡风险加倍
环球医学资讯

 1小时0条评论
1小时0条评论7月22日消息 - 前沿医学资讯网据Medscape报道,美国和欧洲的药物安全监管机构7月21日宣布,作为其正在进行的评价决奈达隆安全性的一部分,其将考虑PALLAS试验的结果。美国食品和药物管理局(FDA)首次提供了在该研究中发现的显著的CV事件的细节。 PALLAS对决...
-
测试:FDA更新对亚甲蓝、利奈唑胺和5-羟色胺的警告
环球医学资讯

 1小时0条评论
1小时0条评论10月25日消息 - 美国食品药物管理局(FDA)七月份已经发布警告,因亚甲蓝或利奈唑胺(商品名Zyvox,辉瑞公司)与5-羟色胺联合使用,可能导致5-羟色胺综合症,应避免同时处方。 近日,FDA宣布这种有害的药物相互作用风险似乎只限定于特定药物,一般情况下,...
-
FDA提示非诺贝酸没有心血管获益
环球医学资讯

 1小时0条评论
1小时0条评论11月16日消息 - 环球医学据悉,本月9日的FDA药物安全通讯称,基于涉及非诺贝特的主要临床试验,该机构认为非诺贝酸(fenofibric acid)可能不会降低患者的主要心血管事件风险。非诺贝特是种前体药物,其活性代谢产物是非诺贝酸。 在发表通讯之前,FDA进行了...
-
FDA批准急性遗传性血管水肿药物Firazyr
环球医学资讯

 1小时0条评论
1小时0条评论8月26日消息 - 前沿医学资讯网据悉,Shire公司宣布,美国食品和药物管理局(FDA)已授予用于18岁及以上成年人的遗传性血管水肿(HAE)急性发作治疗药Firazyr(艾替班特注射液)上市许可。 “到现在为止,HAE患者仍面临着快速得到急性治疗的挑战,如需要前往...
-
FDA批准新型高血压治疗方法进行临床试验
环球医学资讯

 1小时0条评论
1小时0条评论7月13日消息 - 前沿医学资讯网据悉,近日,美敦力宣布,美国FDA已经有条件地批准了SYMPLICITY HTN-3的有关协议,即使用该公司的Symplicity导管系统进行肾脏的去神经支配以治疗顽固性高血压(接受三种或更多药物治疗的高血压患者)的临床试验,全球数以百万计的人...
-
KFDA批准在韩进行DP-b99 III期MACSI研究的IND
环球医学资讯

 1小时0条评论
1小时0条评论8月25日消息 - 前沿医学资讯网据国外媒体报道,D-Pharm公司(特拉维夫:DPRM)近日宣布,韩国食品药品管理局(KFDA)批准在韩国进行DP-b99的III 期MACSI研究的新药临床研究申请(IND)。D- PHARM与其共同研发合作伙伴韩国Yungjin药业有限公司(YJP)联合提交了IN...
-
FDA警告昂丹司琼与心律紊乱有关
环球医学资讯

 1小时0条评论
1小时0条评论9月16日消息 - 前沿医学资讯网据悉,美国食品和药物管理局(FDA)近日宣布,临床医生应避免对患有先天性长QT综合征的患者使用抗呕吐药昂丹司琼(枢复宁,葛兰素史克公司),因为此药会给这类患者造成一个特定风险,此风险是一种被称为扭转型室速的异常及潜在致命...
-
FDA授予PLX Cells孤儿药地位
环球医学资讯

 1小时0条评论
1小时0条评论8月26日消息 - 前沿医学资讯网据悉,Pluristem Therapeutics公司宣布,美国食品和药物管理局(FDA)批准了其用于治疗血栓闭塞性脉管炎(Buerger氏病)的PLX Cells的孤儿药地位。该公司还称,一份在欧洲对欧洲药品管理局(EMA)孤儿药产品委员会(COMP)同时提出...
-
FDA认为降压药Benicar的收益仍超过潜在心血管风险
环球医学资讯

 1小时0条评论
1小时0条评论4月20日消息 - 2011年4月13日,美国食品药品管理局(FDA)发布了一则有关使用抗高血压药物Benicar(奥美沙坦,一种血管紧张素Ⅱ受体拮抗剂)的潜在心血管风险的最新安全性通告,这是对2010年6月发布的相关通告的更新。 FDA正在对2项Benicar临床试验的数据进行评...
-
抗高血压新药Edarbi获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论2月28日消息 - 前沿医学资讯网据MD INDIA网站报道,美国食品和药物管理局(FDA)已批准武田制药抗高血压药Edarbi在美国上市。 该药的商品名为“Edarbi”,是血管紧张素Ⅱ受体阻滞剂(ARB)阿齐沙坦酯(azilsartan medoxomil)的一个衍生物。 Edarbi可阻...
-
氟[18F]脱氧葡糖注射液获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论3月15日消息 - 前沿医学资讯网据悉,美国西门子医疗系统的全资子公司PETNET Solutions近日宣布,氟[18F]脱氧葡糖注射液([18F] FDG)的简化新药申请(ANDA)获得美国食品和药物管理局(FDA)批准。 PETNET Solutions公司提交的ANDA符合先进的放射性药物行业正电...
-
FDA同意评审DEFINITY®用于负荷超声心动图的sNDA
环球医学资讯

 1小时0条评论
1小时0条评论12月15日消息 - 前沿医学资讯网据THE MEDICAL NEWS网站报道,Lantheus 医学影像公司14日宣布,美国FDA已同意评审该公司的补充新药申请(sNDA),即DEFINITY®(全氟丙烷脂质微球体)注射混悬剂应用于负荷超声心动图。DEFINITY®目前适用于次优超声心动图患...
-
抗凝剂Brilinta再次受阻于FDA
环球医学资讯

 1小时0条评论
1小时0条评论12月21日消息 - 前沿医学资讯网据THE MEDICAL NEWS网站报道,阿斯利康新的血液稀释剂Brilinta辜负了大家的期望,FDA再次延迟了其批准。Brilinta通用名称是替格瑞洛(Ticagrelor),与全球第二最畅销的抗凝血药物硫酸氢氯吡格雷(Plavix,波立维)是竞争对手。 ...
-
SFDA药品不良反应信息通报:辛伐他汀
环球医学资讯

 1小时0条评论
1小时0条评论11月17日消息 - 国家食品药品监督管理局提醒警惕辛伐他汀与胺碘酮联合使用或高剂量使用增加横纹肌溶解发生风险。 日前,国家药品不良反应监测中心发布第34期《药品不良反应通报》并表示,近期国外药品管理部门发现辛伐他汀与胺碘酮联合使用或高剂量使用增加...
-
达比加群获FDA批准用于房颤患者卒中一级预防
环球医学资讯

 1小时0条评论
1小时0条评论9月28日消息 - 美国食品与药物管理局(FDA)9月20日召开会议,批准将口服抗凝药达比加群用于AF患者卒中预防。该决定主要依据长期抗凝治疗随机评估(RE-LY)研究,其结果显示,110 mg达比加群作用不弱于华法林,而150 mg强于华法林。此外,与华法林相比,服用达比...
-
ARB增加癌症风险?美国FDA宣布展开审查
环球医学资讯

 1小时0条评论
1小时0条评论7月28日消息 - 7月15日,美国食品与药物管理局(FDA)在其官方网站上宣布,对血管紧张素Ⅱ受体拮抗剂(ARB)是否与癌症发生风险升高相关的问题展开审查。 这次审查源于1个月前在线发表于《柳叶刀·肿瘤学》(Lancet Oncol)杂志的一篇荟萃分析,提示ARB与新...
-
高血压治疗新药Tribenzor获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论7月28日消息 - 前沿医学资讯网据国外媒体报道,近日Tribenzor已通过美国FDA批准,其是一种治疗高血压的三合一药物。 Tribenzor含氨氯地平(同辉瑞公司销售的络活喜)、奥美沙坦酯(同日本第一三共制药销售的Benicar)、氢氯噻嗪。Tribenzor被批准用于那些应...
-
FDA对抗高血压药Benicar 心血管死亡率方面的数据进…
环球医学资讯

 1小时0条评论
1小时0条评论6月18日消息 - 2010年6月11日,美国食品药品管理局(FDA)宣布,两项临床试验的数据表明接受抗高血压药Benicar(奥美沙坦)治疗的患者心血管原因所致的死亡率高于接受安慰剂处置的患者。 在“奥美沙坦与预防糖尿病微量白蛋白尿随机试验(ROADMAP)”和“奥美沙坦降...
-
经FDA批准日本泰尔茂公司将启动美日合作试行计划中…
环球医学资讯

 1小时0条评论
1小时0条评论5月18日消息 - 5月12日,日本医疗器械生产商泰尔茂公司(Terumo)宣布,已获得了美国FDA的附条件批准,在美国开展股浅动脉(SFA)支架Misago 的临床试验,即将开始该试验的患者招募工作。 这项试验将同时在美国和日本招募患者,这是美日两国合作评审III类医疗器...
-
FDA批准达比加群酯用于降低卒中风险
环球医学资讯

 1小时0条评论
1小时0条评论9月25日消息 - 美国食品药品管理局(FDA)于9月20日批准将达比加群酯(一种口服直接凝血酶抑制剂)用于非瓣膜性心房纤颤患者(AF),以降低其发生卒中和全身性血管栓塞的风险。 RE-LY试验(评价抗凝疗法长期效果的随机研究)的结果是FDA做出以上决定的依据。RE-LY试...
-
FDA首次批准2种高血压治疗药的仿制药
环球医学资讯

 1小时0条评论
1小时0条评论4月14日消息 - 前沿医药资讯网从美国FDA网站获悉,4月6日,美国FDA批准两种高血压治疗药物的首个仿制药。氯沙坦钾片、氯沙坦钾氢氯噻嗪片(一种复方药)分别是科素亚和海捷亚的仿制药品。 科素亚和海捷亚片是应用广泛的降压药物。这两种非专利氯沙坦产品将具...
-
美FDA驳回Certriad上市申请 要求提供更多数据
环球医学资讯

 1小时0条评论
1小时0条评论3月31日消息 - 前沿医药资讯网据国外的媒体报道,阿斯利康和雅培表示,美国食品和药物管理局对其提交的胆固醇药物Certriad上市申请,要求其提供更多数据。 该公司表示,FDA已经在Certriad完整答复函(CRL)收集了比较多的有关新药的数据,Certriad是胆固醇药...
-
FDA加强警告:较高剂量的降胆固醇药物Zocor有致肌病…
环球医学资讯

 1小时0条评论
1小时0条评论3月25日消息 - 3月19日,美国食品药品管理局(FDA)发布了一项警告,内容为:与服用较低剂量的辛伐他汀或其他他汀类药物相比,服用最高获准剂量(80 mg)的降胆固醇药物Zocor(辛伐他汀)发生肌肉损伤(肌病)的风险增加。市售的辛伐他汀为一种成分单一的常用药,商品名...
-
复方丹参滴丸Ⅱ期临床完成 10亿元巨资去敲FDA大门
环球医学资讯

 1小时0条评论
1小时0条评论1月20日消息 - 复方丹参滴丸距离敲开美国市场的大门又近了一步。昨日,天津天士力(600535)制药股份有限公司(以下简称“天士力”)披露,其主打产品复方丹参滴丸FDA(美国食品药品监督管理局)Ⅱ期临床试验已经完成,最终结果将在一两个月内公布。 复方丹...
-
美国FDA调查ARBs可能存在的癌症风险
环球医学资讯

 1小时0条评论
1小时0条评论7月20日消息 - 前沿医学资讯网据国外媒体报道,美国FDA在15日发布的人类医疗产品安全警报中表示,该管理机构将调查血管紧张素受体阻断剂(ARBs)与癌症之间存在的可能联系。该行动基于上月《Lancet Oncology》中的一项荟萃分析报告,该分析结果发现原发肺癌略微...
-
FDA批准辉瑞Revatio(R) (Sildenafil)静脉注射液用于…
环球医学资讯

 1小时0条评论
1小时0条评论11月24日消息 - 辉瑞近日宣布FDA已经批准Revatio(sildenafil)静脉注射液用于肺动脉高压治疗。Revatio是FDA批准的唯一具有片剂和注射剂两个剂型的磷酸二酯酶-5 (PDE5)抑制剂。 Revatio用于提高肺动脉高压患者的运动能力和延缓临床病程进展。在依前列醇治疗基...
-
FDA对Plavix与Prilosec联合用药提出警告
环球医学资讯

 1小时0条评论
1小时0条评论11月20日消息 - 11月17日,美国食品药品管理局(FDA)发布了一项警告,是有关抗血小板药氯吡格雷(Plavix)与质子泵抑制剂(PPI)奥美拉唑(Prilosec/Prilosec,非处方药)之间相互作用的最新安全性信息。最新数据显示,氯吡格雷与奥美拉唑同服时,氯吡格雷的疗效降低,...
-
勃林格殷格翰公司的心血管药美卡素和Twynsta获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论10月26日消息 - 10月19日,勃林格殷格翰公司宣布,其2种药品已获美国食品药品管理局(FDA)批准。其一为血管紧张素II受体拮抗剂(ARB)美卡素(替米沙坦);另一获批准的药物为Twynsta(替米沙坦/氨氯地平),该药为ARB替米沙坦和钙通道阻滞剂氨氯地平的复合剂。 美...
-
复方降压药Valturna获得FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论9月25日消息 - 2009年9月17日,诺华公司宣称其产品Valturna已获美国食品药品管理局(FDA)批准用于某些高血压病患者的治疗。Valturna是包括一种血管紧张素受体阻断剂(ARB)缬沙坦和一种直接肾素抑制剂阿利吉仑的复方制剂。Valturna的适应证为单纯阿利吉仑或单纯血管...
-
FDA批准另一个宫颈癌疫苗
环球医学资讯

 1小时0条评论
1小时0条评论10月22日消息 - 10月16日,葛兰素史克公司宣布美国食品药品管理局(FDA)已批准将疫苗保蓓 [人类乳头状瘤病毒重组二价(16和18型)疫苗,Cervarix]应用于10~25岁女性以预防与致瘤性16和18型人类乳头状瘤病毒(HPV)相关的宫颈癌前病变和宫颈癌。发生在北美的宫颈癌中大...
-
用于9个月儿童脑膜炎球菌疫苗Menactra获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论4月24日消息 - 前沿医学资讯网据悉,用于预防9个月儿童侵入性脑膜炎球菌病的疫苗Menactra已获美国食品和药物管理局(FDA)批准。目前,该疫苗已经上市,用于2~55岁患者,其可以抵御脑膜炎奈瑟菌血清型甲、丙、Y和W- 135。 脑膜炎球菌病是指由脑膜炎奈瑟...
-
美FDA减轻ADHD治疗药物致心脏病风险的担忧
环球医学资讯

 1小时0条评论
1小时0条评论4月13日消息 - 前沿医学资讯网据悉,美国药品监管机构在对一项关于苯丙胺(Adderall XR)和利他林等兴奋剂的潜在致心脏病风险研究进行了回顾后表示,其不建议对这类药物用于治疗注意力缺陷多动障碍(ADHD)的使用做修改。 美国食品药物管理局(FDA)在其网站...
-
FDA警告对早产儿禁用SimplyThick
环球医学资讯

 1小时0条评论
1小时0条评论5月26日消息 - 前沿医学资讯网据悉,美国食品和药物管理局(FDA)发布警告,告诉临床医师和家长不要用SimplyThick喂哺妊娠不足37周出生的早产儿。 在发出上述警告前,FDA获悉喂哺SimplyThick(SimplyThick,LLC)的早产儿出现15例坏死性肠炎(NEC)病例,并...
-
美国FDA批准氯解磷定用于小儿化学中毒的治疗
环球医学资讯

 1小时0条评论
1小时0条评论9月13日消息 - 前沿医学资讯网据美国FDA网站报道,美国FDA已批准儿科使用氯解磷定,其用于治疗有机磷农药和化学药品(如神经毒剂)所致中毒。该药物被批准经静脉注射(IV)或肌肉注射(IM)给药。 “我们知道,氯解磷定被广泛用于治疗紧急情况下儿科患者的...
-
FDA批准首个用于治疗半夜惊醒后难再入睡的安眠药
环球医学资讯

 1小时0条评论
1小时0条评论11月25日消息 - 环球医学据悉,美国食品和药品管理局(FDA)于23日批准酒石酸唑吡坦舌下含服片(商品名Intermezzo)按需使用,用于治疗特征为半夜惊醒后难再入睡类型的失眠。 这是FDA首次批准用于这种疾病的安眠药。Intermezzo应只用于失眠者还可以在床上睡...
-
中国仿制药缓释喹硫平获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论12月17日消息 - 前沿医学资讯网据悉,复星医药参股公司汉达药业12月中旬收到美国FDA正式通知,预批准了其仿制大品种缓释喹硫平(tentative approval),这是中国医药企业关联公司中第一个首仿获批的产品。 FDA的预许可基于汉达仿制药申请的资料符合美国FDA规...
-
Viibryd治疗抑郁症获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论1月26日消息 - 前沿医学资讯网据悉,美国食品和药物管理局(FDA)批准Viibryd片(维拉佐酮盐酸盐)治疗成人严重抑郁症。 严重抑郁症也叫重性抑郁,其体征和症状包括:情绪忧郁、对日常活动失去兴趣、体重减轻食欲不振、失眠或嗜睡、躁动、易感疲劳、内疚或无...
-
FDA正在制定长期全球化战略
环球医学资讯

 1小时0条评论
1小时0条评论2月24日消息 - FDA称,鉴于医疗器械和药品行业的日益全球化,FDA必须转变体制,不能再单纯依靠FDA自身的工作人员,而需要与其他国家共享相关数据和资源。 继1月Joshua Sharfstein 离任后,最近被任命为FDA代理第一副局长的John Taylor说:“在当今的格局下,...
-
FDA针对膳食补充剂AER提出更加严格的风险-效益标准
环球医学资讯

 1小时0条评论
1小时0条评论5月17日消息 - FDA针对膳食补充剂严重不良事件报告(AER)的评价,提出了比药品AER更为严格的风险阈值要求,一名FDA官员称,这是因为膳食补充类产品尚存在许多“不确定性”。 FDA食品安全和实用营养中心分管膳食补充剂的监督主管Robert Moore说,涉及药品的严...
-
FDA将审查己酸羟孕酮注射剂Makena的合成药的数据
环球医学资讯

 1小时0条评论
1小时0条评论11月14日消息 - 美国食品和药物管理局(FDA)在今日发表的声明中表示,即将评估己酸羟孕酮注射液(Makena,K-V制药公司制)合成药的效力及纯度的生产数据。 该局于今年2月3日批准将Makena作为专业注射剂用于既往有单胎自发性早产史的37周内单胎妊娠孕妇。此...
-
FDA批准长效Lupron治疗中枢性性早熟
环球医学资讯

 1小时0条评论
1小时0条评论8月18日消息 - 前沿医学资讯网据悉,雅培公司表示,食品和药物管理局(FDA)已批准其药物Lupron的两个长效剂量用于治疗青春期性早熟。 雅培表示,FDA批准了Lupron的两种剂量,每一个剂量均可持续作用三个月,患者可每年注射4次该药物,无需每月1次。监管机构...
-
FDA:艾替班特可有效治疗遗传性血管性水肿
环球医学资讯

 1小时0条评论
1小时0条评论6月23日消息 - 前沿医学资讯网据medscape报道,近日,美国食品和药物管理局的工作人员表示,在一项关键的临床试验中,Shire Plc的药物Firazyr(艾替班特)可有效治疗遗传性血管水肿引起的严重肿胀。 该注射用药物Firazyr(艾替班特)正在接受美国的审查。 ...
-
SFDA:紧急停售“俏妹牌减肥胶囊”有关批次产品
环球医学资讯

 1小时0条评论
1小时0条评论2月22日消息 - 前沿医学资讯网据悉,2月21日,国家食品药品监督管理局(SFDA)网站发布紧急通知,在全国范围内立即停售产品名称标示为“俏妹牌减肥胶囊”的保健食品,因其有关批次产品违禁物质经检测呈阳性。 据介绍,北京市药品监督管理局日前在市场监督抽...
-
FDA将监控TIDE研究
环球医学资讯

 1小时0条评论
1小时0条评论7月29日消息 - 7月21日,美国食品与药物管理局(FDA)宣称,将对噻唑烷二酮及维生素D干预疗效评价(TIDE)研究施行部分监控,这意味着在FDA发表声明之前,该研究不可再纳入新的患者,已参与至该研究中的患者可继续服药。 FDA正在对现有的罗格列酮安全性资料...
-
FDA严格限制Thyrogen的使用
环球医学资讯

 1小时0条评论
1小时0条评论5月26日消息 - 2010年5月24日,美国食品药品监督管理局及Genzyme公司进行法律程序同意判决书签署了同意Genzyme在美国市场生产销售Thyrogen,以满足当地患者的需要。该同意判决书严格的限制Genzyme公司在美国的配送包括相关分销商和批发商,均按照规程颁发医药必...
-
新的迟发性庞贝氏症药物获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论5月26日消息 - 美国食品药品监督管理局批准了Lumizyme (alglucosidase alfa)用于8岁及以上儿童的迟发性庞贝氏症的治疗,庞贝氏症是一种罕见的遗传病,新生儿的发病率大约为每4万到30万人有1例患者,其原发性症状为心脏肥大、骨骼肌无力、呼吸困难等。 Lumizy...
-
美国FDA专家反对减肥药Qnexa上市
环球医学资讯

 1小时0条评论
1小时0条评论7月19日消息 - 负责提供建议的美国食品药物管理局(FDA)专家委员会昨日针对新减肥药Qnexa上市进行投票,最后以有安全风险为由,反对让这项药品销售。 按规定,FDA无须遵从内分泌与新陈代谢药物专家的建议,但一般都会接受专家小组的意见。 由加州生技...
-
FDA对奥利司他的标签进行了修改
环球医学资讯

 1小时0条评论
1小时0条评论6月17日消息 - 美国FDA近日通知医务工作者和患者,其对奥利司他的标签进行了修改,添加了新的安全信息——虽然报告较少,但已有奥利司他引起严重肝损伤的病例。 据介绍,商品名为“赛尼可”的处方药和商品名为Alli的非处方药均含有相同的活性成分奥利司他...
-
由减肥药赛尼可和阿莱所致的少数几例重度肝损伤促使…
环球医学资讯

 1小时0条评论
1小时0条评论5月31日消息 - 2010年5月26日,美国食品药品管理局(FDA)宣布,因发生少数几例重度肝损伤事件,减肥药赛尼可(Xenical)和阿莱(Alli)的产品说明书中将补充相关的安全性信息。据报道,美国1位阿莱服用者和美国以外其他国家12位赛尼可服用者发生了重度肝损伤。其中某...
-
FDA警告:Que She 减肥胶囊含有潜在有害组分
环球医学资讯

 1小时0条评论
1小时0条评论7月13日消息 - 2010 年7月8日,美国食品药物管理局(FDA)发出警告,作为草本减肥补充剂上市的Que She含有未列示于产品标签上的活性药物组分,可能对消费者特别是对那些患心血管疾病的消费者构成危害。 Que She 被宣传为“减肥因子胶囊”以及“全天然中草药...
-
FDA会议公布的罗格列酮安全性投票结果含混不清
环球医学资讯

 1小时0条评论
1小时0条评论7月16日消息 - 备受瞩目的美国食品与药物管理局(FDA)顾问委员会关于罗格列酮安全性的会议日前产生投票结果,在5个选项中建议罗格列酮撤市的意见得票最多,但票数少于另外4项的得票总和。这一结果究竟是敲响了罗格列酮的“丧钟”,还是其最后的“救生筏”,仍旧...
-
FDA批准萘普生/埃索美拉唑复方制剂用于治疗有胃溃疡…
环球医学资讯

 1小时0条评论
1小时0条评论5月14日消息 - 前沿医药资讯网据国外媒体报道,美国食品药品监督管理局(FDA)已批准一种同时含有延释肠溶型萘普生(naproxen)和速释型埃索美拉唑镁(esomeprazole magnesium)的混合剂量片剂(商品名为Vimovo,生产商为阿斯利康和Pozen公司)用于缓解骨关节炎...
-
FDA:丙硫氧嘧啶可引起严重肝损伤
环球医学资讯

 1小时0条评论
1小时0条评论4月23日消息 - 2010年4月21日,美国食品药品监督管理局在审查了上市后临床研究报告之后,对甲状腺机能亢进药物丙硫氧嘧啶的药品说明书加了黑框警告,称其可能引起严重肝损伤及急性肝衰竭,一些成人及儿童患者还有生命危险。新的警告声明,使用丙硫氧嘧啶的患者一...
-
FDA批准Carbaglu用于治疗罕见的酶缺乏性疾病
环球医学资讯

 1小时0条评论
1小时0条评论3月24日消息 - 18日,美国食品药品管理局(FDA)宣布批准Carbaglu (carglumic 酸)作为儿童和成人肝脏N-乙酰谷氨酸合成酶(NAGS)缺乏所致急性高氨血症的治疗药物。同时还批准该药物作为NAGS缺乏所致慢性高氨血症的维持治疗药物。 该药物生产厂家Recordati公司...
-
FDA警告Genzyme公司的部分注射剂产品可能受污染
环球医学资讯

 1小时0条评论
1小时0条评论11月19日消息 - 11月13日,美国食品药品管理局(FDA)宣布Genzyme公司发布了一则警示信息,提醒医务人员警惕其生产的数种用于治疗罕见、严重且危及生命疾病的产品可能被异物污染。这些异物包括不锈钢碎片、瓶塞上的非乳胶橡胶以及来自生产过程的纤维样物质,部分产...
-
Carbaglu获FDA内分泌及代谢药物咨询委员会肯定
环球医学资讯

 1小时0条评论
1小时0条评论1月15日消息 - 美国FDA内分泌及代谢药物咨询委员会近日以12票全票赞成的投票结果,肯定了意大利Recordati公司高氨血症治疗药Carbaglu。 高氨血症是一种罕见的常染色体遗传性疾病,其可导致N-乙酰谷氨酸合成酶(NAGS)缺乏。而NAGS的缺乏会导致患者体内血氨水...
-
FDA正考虑下架减肥药诺美婷
环球医学资讯

 1小时0条评论
1小时0条评论9月15日消息 - 由于最新研究显示风靡全球的处方减肥药诺美婷可能增加心脏病突发和中风的风险,美国食品和药物管理局13日要求有关专家小组在本周内就是否下架诺美婷做出决定。 药管局当天发表公告说,该机构内分泌和新陈代谢药物咨询委员会专家小组将于15日举...
-
FDA开始对glucarpidase进行审查
环球医学资讯

 1小时0条评论
1小时0条评论9月26日消息 - 前沿医学资讯网据悉,一家专业的医疗保健公司BTG plc宣布,美国食品和药物管理局(FDA)已经接受了对glucarpidase生物制剂许可申请(BLA)的审查,并已授予其优先审查地位。 美国食品药物管理局已指出,目前,其对BLA的初步审查没有确定任何潜...
-
FDA依然关注屈螺酮的静脉血栓栓塞风险
环球医学资讯

 1小时0条评论
1小时0条评论9月26日消息 - 前沿医学资讯网据悉,尽管美国食品和药物管理局(FDA)还没有得出结论,但该机构说,它仍然关注在服用含屈螺酮口服避孕药的女性中发现的增加约50%的静脉血栓栓塞(VTE)风险。 在今日公布的安全审查更新中,FDA表示它已完成对2011年的两项旨在...
-
FDA批准肉毒杆菌用于治疗特定类型的尿失禁
环球医学资讯

 1小时0条评论
1小时0条评论8月25日消息 - 前沿医学资讯网据悉,近日,美国食品和药物管理(FDA)批准肉毒杆菌(onabotulinumtoxinA)注射剂用于治疗神经系统疾病引起的尿失禁,例如脊髓损伤和膀胱过度活动的多发性硬化患者。 患神经系统疾病的患者无法制止膀胱收缩,可导致无法储存尿...
-
FDA批准Nulojix 用于预防肾移植后急性排斥反应
环球医学资讯

 1小时0条评论
1小时0条评论6月17日消息 - 前沿医学资讯网据美国FDA网站报道,近日,美国食品和药物管理局(FDA)批准Nulojix(belatacept)用于肾移植成人患者以预防急性排斥反应。并批准该药物与其他免疫抑制剂联用,尤其是巴利昔单抗、吗替麦考酚酯和皮质类固醇。 Nulojix属于选择...
-
美FDA警告5-α还原酶抑制剂有致前列腺癌风险
环球医学资讯

 1小时0条评论
1小时0条评论6月13日消息 - 前沿医学资讯网据悉,近日,美国食品和药物管理局(FDA)警告医疗专业人士5-α还原酶抑制剂(5-ARIs)标签有变更,所述药物包括度他雄胺(Dutasteride)和非那雄胺(Finasteride)。 这些药物的说明书现警告,患者在服用这些药物时,他们确诊...
-
美FDA批准Zytiga用于治疗晚期前列腺癌
环球医学资讯

 1小时0条评论
1小时0条评论4月29日消息 - 前沿医学资讯网据悉,近日,美国食品和药物管理局批准了Zytiga(阿比特龙醋酸盐)与强的松(类固醇)联合用于治疗晚期(转移)去势抵抗前列腺癌患者,这些患者先前已经接受过多西他赛化疗。 对于前列腺癌患者,男性荷尔蒙睾丸激素刺激前列腺肿...
-
FDA批准Glenmark公司的仿制避孕药在美国上市
环球医学资讯

 1小时0条评论
1小时0条评论6月23日消息 - 前沿医学资讯网据悉,孟买的Glenmark制药公司宣布,美国FDA已批准其美国子公司——Glenmark Generics公司的仿制避孕药在该国上市。 根据该公司发布的声明,FDA最终批准生产诺孕酯和炔雌醇片的规格是0.18mg/0.035mg、0.215mg/0.035mg和0.25/0.0...
-
前列腺癌药物醋酸亮丙瑞林新的配方获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论6月22日消息 - 前沿医学资讯网据悉,雅培公司宣布,美国FDA已经批准了醋酸亮丙瑞林一个新的45 mg六个月治疗的配方,用于晚期前列腺癌患者的姑息治疗。 雅培全球医药开发副总裁Eugene Sun表示,对于许多晚期前列腺癌患者,醋酸亮丙瑞林是一种重要的治疗选择。...
-
FDA批准了腋下应用的新型局部外用睾酮替代药
环球医学资讯

 1小时0条评论
1小时0条评论11月29日消息 - 2010年11月23日,美国礼来公司宣布,美国食品药品管理局(FDA)已批准Axiron(睾酮)局部外用涂液CIII用于患有某些睾酮缺乏相关疾病的男性,作为替代治疗药。这些疾病包括原发性性腺机能减退症(先天性或获得性)和低促性腺激素性性腺功能减退症(先天性...
-
FDA批准睾酮凝胶大腿部位用药
环球医学资讯

 1小时0条评论
1小时0条评论12月31日消息 - 前沿医学资讯网据悉,宾夕法尼亚州查兹福特的远藤制药(Endo Pharmaceuticals)称,该公司研发的用于大腿皮肤表面治疗男性睾酮缺乏的睾酮凝胶(Fortesta)已获得美国FDA批准。 Fortesta是一种局部应用的2%睾酮凝胶制剂,采用了可以精确定量...
-
拜耳含有叶酸补充剂的避孕药Safyral获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论12月24日消息 - 2010年12月17日,拜耳医疗保健公司宣布,美国食品药品管理局(FDA)已经批准口服避孕药(OC) Safyral,该药是含有避孕药优思明中的激素成分与稳定型天然叶酸衍生物L-甲基叶酸盐(主要存在于食物中)的复方制剂。生产厂家声明,大量的确凿证据支持育龄...
-
FDA警告消费者切勿使用男性性功能增强 “膳食补充剂…
环球医学资讯

 1小时0条评论
1小时0条评论11月29日消息 - 2010年11月19日,美国食品药品管理局(FDA)发布一则警告,提醒消费者切勿使用或购买活力-25(Vigor-25),该产品是一种市售的天然膳食补充剂,可增强男性的性功能。FDA正在对一名26岁男性的死亡报告进行调查,初步判断其死因可能与使用活力-25有关。...
-
FDA已经批准拜耳含叶酸避孕药Beyaz上市销售
环球医学资讯

 1小时0条评论
1小时0条评论9月28日消息 - 近日,美国食品药品监督管理局批准拜耳公司申请的联用避孕药Beyaz,该药物是雌激素(戊酸雌二醇)和孕激素(地诺孕素)及叶酸 (添加左甲基四氢叶酸钙0.451mg)的联用药物。 左甲基四氢叶酸钙是叶酸代谢物,是产生和维持人体内新细胞的水溶性维生素...
-
FDA警告消费者避免服用“超时”胶囊
环球医学资讯

 1小时0条评论
1小时0条评论8月27日消息 - 前沿医学资讯网据美国FDA官方网站报道,美国食品和药物管理局(FDA)警告消费者不要服用“超时( TimeOut)”胶囊,因其所含的一种有效成分可以降低血压而造成危险。该产品作为一种膳食补充剂已增强性功能推向市场。 “超时”标示为“100%纯...
-
另一种性功能增强药物在经FDA分析显示含有未申报的…
环球医学资讯

 1小时0条评论
1小时0条评论8月26日消息 - 圣路易斯(MD Consult)—2010年8月13日,美国食品药品管理局(FDA)宣布美国Prolatis有限责任公司正在全美范围内主动召回以Prolatis商品名出售的药品。做出此次召回决定的起因是Prolatis公司得知FDA药品分析表明其产品中含有西地那非类似物sulfoailde...
-
美国FDA专家组将关注效能长达5天的紧急避孕药醋酸ul…
环球医学资讯

 1小时0条评论
1小时0条评论6月21日消息 - 美国食品药品管理局(FDA)顾问专家组将评估以下证据,即醋酸ulipristal可在无保护性交或已知(或怀疑)避孕失败120 h内作为紧急避孕剂使用的效果。 醋酸ulipristal是一种新化学实体,其作用机制与左炔诺孕酮不同,目前已获批用于紧急避孕(EC)。醋...
-
用于治疗良性前列腺增生症(BPH)的新型复方药品Jalyn…
环球医学资讯

 1小时0条评论
1小时0条评论6月21日消息 - 2010年6月14日,葛兰素史克公司宣布,美国食品药品管理局(FDA)已批准Jalyn——一种由度他雄胺(0.5 mg)与坦索罗辛(0.4 mg)构成的复方胶囊制剂——用于治疗有症状的良性前列腺增生症(BPH)。度他雄胺(商品名为Avodart)目前已获准用于治疗有症状的BPH...
-
FDA否决女性性功能药Girosa
环球医学资讯

 1小时0条评论
1小时0条评论6月21日消息 - 美国食品药物管理局(FDA)的顾问小组最近一致否决通过一种刺激妇女性欲的药品。 FDA的生育健康药物咨询委员会(Reproductive Health Drugs Advisory Committee)表示,目前呈上的证据,无法证明德国药厂生产的药物flibanserin有效。 即...
-
FDA批准新型避孕药
环球医学资讯

 1小时0条评论
1小时0条评论5月16日消息 - 2010年5月6日,美国食品药品管理局(FDA)和拜耳制药公司(Bayer HealthCare Pharmaceuticals)宣布,避孕药Natazia (戊酸雌二醇和戊酸雌二醇/地诺孕素)片剂正式获批。美国加州托兰斯加州大学洛杉矶分校Harbor医学中心的妇产科教授Anita Nelson博士说...
-
FDA批准ella用于紧急避孕
环球医学资讯

 1小时0条评论
1小时0条评论8月17日消息 - 美国FDA近日批准新药埃拉(ella,ulipristal acetate)片剂用于紧急避孕。在避孕工具失败或无保护性行为后120小时(5天)内服用此处方药可预防妊娠,但其不能用于常规避孕。ella于2009年5月起开始在欧洲市场销售,其主要作用机制为抑制或延迟排卵...
-
FDA批准宫颈癌疫苗Gardasil新的适应症 供男性预防生…
环球医学资讯

 1小时0条评论
1小时0条评论前沿医药(Med-front.com)10月19日消息 - 墨克公司的Gardasil疫苗于10月16日获得美国FDA的批准,用于预防6型和11型因人乳头状病毒感染引起的生殖器疣,获批注射对象为9-26岁的男性。 在美国,每年每1000个人中有2个以上的人会被新诊断患上生殖器疣。 Ga...
-
FDA研究双膦酸盐与食管癌之间的相关性
环球医学资讯

 1小时0条评论
1小时0条评论7月22日消息 - 前沿医学资讯网据Medscape报道,美国食品和药物管理局(FDA)7月21日宣布,其将继续对开具口服双膦酸盐治疗骨质疏松症是否与食管癌风险增加相矛盾的研究结果进行审查。 美国食品药物管理局强调,它还没有得出这一类药物会增加食管癌风险的结论...
-
FDA批准皮下给药的Gammagard
环球医学资讯

 1小时0条评论
1小时0条评论7月27日消息 - 前沿医学资讯网据悉,Baxter国际公司宣布,美国食品和药物管理局(FDA)已批准10%GAMMAGARD LIQUID皮下给药用于原发性免疫缺陷(PI)患者。这一新的给药途径的批准,将会使医生和PI患者一起工作,以确定哪种GAMMAGARD LIQUID的给药途径是最合适...
-
FDA公布对戈利木单抗扩大适应症申请的完整答复函
环球医学资讯

 1小时0条评论
1小时0条评论7月26日消息 - 前沿医学资讯网据悉,总部设在美国的扬森生物技术公司日前宣布,美国食品和药物管理局(FDA)已对SIMPONI(戈利木单抗)的补充生物制品许可申请(sBLA)发出了一个完整答复函。 该申请于2010年9月提交,目的是扩大SIMPON的标签,添加阻止中至重度...
-
FDA批准异丙嗪片的仿制药
环球医学资讯

 1小时0条评论
1小时0条评论9月15日消息 - 前沿医学资讯网据悉,Mylan公司表示,美国食品和药物管理局(FDA)已批准其用来治疗季节性过敏症状的异丙嗪片的仿制药。 Mylan公司表示,FDA已批准其12.5、25和50毫克的仿制片剂。该公司称,截至6月30日,在12个月内,这些药片在美国的销售总...
-
FDA批准皮下给药的Gammagard
环球医学资讯

 1小时0条评论
1小时0条评论7月27日消息 - 前沿医学资讯网据悉,Baxter国际公司宣布,美国食品和药物管理局(FDA)已批准10%GAMMAGARD LIQUID皮下给药用于原发性免疫缺陷(PI)患者。这一新的给药途径的批准,将会使医生和PI患者一起工作,以确定哪种GAMMAGARD LIQUID的给药途径是最合适...
-
FDA批准利妥昔单抗用于治疗两种罕见疾病
环球医学资讯

 1小时0条评论
1小时0条评论4月21日消息 - 前沿医学资讯网据悉,美国食品和药品管理局(FDA)于4月19日批准利妥昔单抗(Rituximab,商品名美罗华Rituxan)联合糖皮质激素(类固醇)用于治疗韦格纳氏肉芽肿(WG)和显微镜下多血管炎(MPA)患者,这两种罕见疾病均可引发血管炎。 WP和MPA...
-
FDA专家小组投票反对对痛风药ACZ885
环球医学资讯

 1小时0条评论
1小时0条评论6月24日消息 - 前沿医学资讯网据悉,美国食品和药物管理局(FDA)咨询委员会投票反对ACZ885(canakinumab),因担忧ACZ885用于治疗非甾体抗炎药或秋水仙碱不能获得充分缓解的痛风性关节炎患者的整体安全性。委员会成员提出将其用于治疗更窄的痛风性关节炎人群的...
-
FDA接受缓释卡比沙明口服混悬剂治疗儿童过敏症的新…
环球医学资讯

 1小时0条评论
1小时0条评论3月15日消息 - 前沿医学资讯网据THE MEDICAL NEWS网站报道,据一家开发创新药物给药技术专业制药公司ShareTris制药近日宣布,美国食品和药物管理局(FDA)已接受缓释卡比沙明口服混悬剂的新药申请(NDA),该药用于治疗2岁及以上儿童过敏症。如果获得批准,Tris...
-
托珠单抗获FDA批准用于治疗罕见类型儿童关节炎
环球医学资讯

 1小时0条评论
1小时0条评论4月19日消息 - 前沿医学资讯网据悉,美国食品和药品管理局(FDA)4月15日批准托珠单抗(Tocilizumab,商品名Actemra)单用或者与甲氨喋呤联合用于治疗2岁及以上儿童的活动期全身型幼年特发性关节炎(SJIA)。 SJIA又称斯蒂尔病(Still’s disease),是在儿...
-
FDA在那他珠单抗说明书中增加更多风险信息
环球医学资讯

 1小时0条评论
1小时0条评论4月26日消息 - 前沿医学资讯网据悉,那他珠单抗Natalizumab(商品名Tysabri,由比奥根艾迪克公司生产)的说明书近日作了更新,以进一步向服用这种药物的患者强调该药致进行性多灶性脑白质病(PML)的风险。新说明书也将现有预防提示(precaution)从在用药同时使...
-
FDA再次警告TNF抑制剂与青少年淋巴瘤风险增加相关
环球医学资讯

 1小时0条评论
1小时0条评论4月18日消息 - 前沿医学资讯网据悉,美国食品药物管理局(FDA)近日通报,该局持续收到使用肿瘤坏死因子(TNF)抑制剂、硫唑嘌呤(Azathioprine)和/或巯嘌呤(Mercaptopurine)进行治疗的青少年和年轻人患肝脾T细胞淋巴瘤(HSTCL)的报告。HSTCL是一种侵袭性肿...
-
FDA批准幼年关节炎新药
环球医学资讯

 1小时0条评论
1小时0条评论4月19日消息 -近日美国食品与药物管理局(FDA)发布公告,批准Actemra(活性成分:tocilizumab)单独给药或与甲氨蝶呤合用,来治疗2岁及以上儿童的活动性全身型幼年特发性关节炎(SJIA)。 SJIA,或称Still病,是儿童中一种罕见的、有可能威胁生命的疾病,...
-
FDA专家组将评估红斑狼疮治疗新药
环球医学资讯

 1小时0条评论
1小时0条评论11月15日消息 - 本周二,美国FDA将围绕狼疮治疗新药Benlysta召开专家组讨论会并投票,该药尚处于研发阶段,由人类基因科技公司(HGS)和GSK合作开发。 在会议召开之前,关于药物的检测评估文件已在FDA的官方网站提前公布。HGS希望该药能用于那些同时采用标...
-
RHUCIN用于治疗遗传性血管水肿的申请已向FDA提交
环球医学资讯

 1小时0条评论
1小时0条评论12月30日消息 - 前沿医学资讯网据biospectrumasia报道,美国生物制药公司Santarus和荷兰生物技术公司Pharming Group宣布已向美国食品和药物管理局(FDA)提交了RHUCIN(重组人C1抑制剂)的生物制品许可申请(BLA),用于治疗遗传性血管水肿(HAE)患者急性血管性...
-
FDA警示来氟米特严重肝损害风险
环球医学资讯

 1小时0条评论
1小时0条评论7月28日消息 - 近日,美国食品与药物管理局(FDA)新添类风湿性关节炎治疗药物来氟米特的严重肝损害警示内容,目的在于提醒患者警惕该药严重肝损害风险,以及如何降低上述风险。既往FDA警示内容为,来氟米特禁用于妊娠女性和未采取可靠避孕措施的育龄女性。 ...
-
美国FDA收到非布索坦引发严重超敏反应的报告
环球医学资讯

 1小时0条评论
1小时0条评论5月24日消息 - 截至5月12日,美国食品药品管理局(FDA)共收到11例非布索坦引发超敏反应的报告。 该机构应要求披露说,在这11例病例中,有2例过敏反应,1例血管性水肿,2例Stevens-Johnson综合征和6例皮疹/过敏。有2例患者接受入院治疗,没有患者死亡。该信息...
-
FDA建议医务工作者明确移植用药物雷帕鸣的TDM分析方…
环球医学资讯

 1小时0条评论
1小时0条评论1月13日消息 –FDA于11日宣布惠氏公司已向医务工作者发出雷帕鸣(西罗莫司)处方信息更改的通告,建议处方医生应十分清楚接受雷帕鸣治疗的每例患者所使用的治疗药物监测(TDM)分析方法类型。 雷帕鸣是一种用于预防13岁及以上的肾脏移植接受者发生器官排斥反应的...
-
FDA研究双膦酸盐与食管癌之间的相关性
环球医学资讯

 1小时0条评论
1小时0条评论7月22日消息 - 前沿医学资讯网据Medscape报道,美国食品和药物管理局(FDA)7月21日宣布,其将继续对开具口服双膦酸盐治疗骨质疏松症是否与食管癌风险增加相矛盾的研究结果进行审查。 美国食品药物管理局强调,它还没有得出这一类药物会增加食管癌风险的结论...
-
FDA再次警告TNF抑制剂与青少年淋巴瘤风险增加相关
环球医学资讯

 1小时0条评论
1小时0条评论4月18日消息 - 前沿医学资讯网据悉,美国食品药物管理局(FDA)近日通报,该局持续收到使用肿瘤坏死因子(TNF)抑制剂、硫唑嘌呤(Azathioprine)和/或巯嘌呤(Mercaptopurine)进行治疗的青少年和年轻人患肝脾T细胞淋巴瘤(HSTCL)的报告。HSTCL是一种侵袭性肿...
-
FDA批准幼年关节炎新药
环球医学资讯

 1小时0条评论
1小时0条评论4月19日消息 -近日美国食品与药物管理局(FDA)发布公告,批准Actemra(活性成分:tocilizumab)单独给药或与甲氨蝶呤合用,来治疗2岁及以上儿童的活动性全身型幼年特发性关节炎(SJIA)。 SJIA,或称Still病,是儿童中一种罕见的、有可能威胁生命的疾病,...
-
FDA批准首个莫米松植入式给药系统用于治疗慢性鼻窦炎
环球医学资讯

 1小时0条评论
1小时0条评论8月16日消息 - 前沿医学资讯网据悉,美国食品和药物管理局(FDA)已批准新颖的糠酸莫米松植入式给药系统,为慢性鼻窦炎患者提供控释给药。 该设计是首个直接对鼻窦黏膜控制性给予类固醇药物的产品。一旦通过内窥镜手术植入,生物可吸收性的药物释放支...
-
FDA批准Eylea用于治疗老年人湿性年龄相关黄斑变性
环球医学资讯

 1小时0条评论
1小时0条评论11月21日消息 - 环球医学据悉,美国食品和药品管理局(FDA)今天批准Eylea(商品名aflibercept)用于治疗湿性(新生血管性)年龄相关性黄斑变性(AMD),该病是致年龄60岁以上的美国人视力下降并失明的主要病因。 AMD逐渐破坏人的敏锐集中的视力,病变累及黄...
-
黑色素瘤新药Vemurafenib的上市申请已向FDA和EMA提交
环球医学资讯

 1小时0条评论
1小时0条评论5月16日消息 - 前沿医学资讯网据悉,Vemurafenib是一种新型口服药物,其靶向在约半数黑色素瘤癌症和约8%所有实体瘤中存在的癌基因BRAF突变。日本第一三共株式会社已向美国食品和药物管理局(FDA)和欧洲药品管理局(EMA)提交了该药的上市申请,申请批准用于治疗...
-
缓释氟轻松醋酸酯遭驳回后重新向FDA提交新药申请
环球医学资讯

 1小时0条评论
1小时0条评论5月17日消息 - 前沿医学资讯网据悉,开发缓释给药产品用于治疗眼底疾病的领军企业pSivida公司近日宣布,获得治疗糖尿病性黄斑水肿(DME)在研新药缓释氟轻松醋酸酯(Iluvien)许可的Alimera科学公司(Alimera Sciences, Inc.)于今年5月12日向美国食品和药品管理...
-
湿性AMD治疗药VEGF Trap-Eye已向FDA提交申请
环球医学资讯

 1小时0条评论
1小时0条评论2月24日消息 - 前沿医学资讯网据THE MEDICAL NEWS网站报道,Regeneron制药公司(Nasdaq:REGN)宣布,该公司向美国食品和药物管理局(FDA)提交了治疗年龄相关性黄斑变性(湿性AMD)新生血管形成的VEGF Trap-Eye的生物制品许可申请(BLA)。根据处方药用户收费法...
-
Shire已递交美国FDA Fabry病治疗药Replagal的销售申请
环球医学资讯

 1小时0条评论
1小时0条评论12月25日消息 - 日前,Shire公司已向FDA递交其Fabry病治疗药Replagal的销售申请,正待FDA批准,有望解决治疗Fabry病药物供应紧缺状况。 Shire公司于2001年已获准在欧洲地区销售Replagal,到目前为止已有45个国家批准这种药物进入市场。去年夏天,Genzyme公司...
-
日光性荨麻疹防治药Afamelanotide获FDA肯定
环球医学资讯

 1小时0条评论
1小时0条评论12月21日消息 - Clinuvel公司近日宣布,其日光性荨麻疹(SU)防治药Afamelanotide再次被FDA指定为罕见病治疗药物,此前该药也已被指定为罕见病用药治疗生血性卟啉症。 Clinuvel公司首席执行官菲利普·沃根表示:“这一喜讯让我们对Afamelanotide的开发前景信...
-
FDA批准首个治疗罕见的骨髓纤维化药物Jakafi
环球医学资讯

 1小时0条评论
1小时0条评论11月18日消息 - 环球医学据悉,美国食品和药品管理局(FDA)于本月16日批准Jakafi(ruxolitinib)为首个专门用于治疗骨髓纤维化患者的药物。 骨髓纤维化是一种罕见骨髓疾病,其中骨髓被瘢痕组织替代,导致血细胞在肝脏和脾脏等器官中生成。这种疾病的特征是...
-
FDA批准用Erwinaze来治疗急性淋巴细胞性白血病
环球医学资讯

 1小时0条评论
1小时0条评论11月18日消息 - 环球医学据悉,美国食品和药品管理局今天批准Erwinaze(天门冬酰胺酶菊欧氏杆菌(Erwinia chrysanthemi))用于治疗急性淋巴细胞性白血病(ALL)患者,这些患者对于用大肠杆菌源的天冬酰胺酶和培加帕酶[培加帕酶聚乙二醇化天门冬酰胺酶]化疗药物...
-
FDA批准首个脐带血产品
环球医学资讯

 1小时0条评论
1小时0条评论11月14日消息 - 环球医学据悉,近日,美国食品和药品管理局(FDA)批准了首个造血祖细胞-脐带(HPC-C)细胞疗法产品HEMACORD。 该产品适用于患影响造血系统的疾病的患者的造血干细胞移植手术。例如,脐带血移植已用于治疗患某些白血病和一些遗传性代谢和免疫系...
-
FDA接受Peginesatide 治疗CKD患者贫血新药申请
环球医学资讯

 1小时0条评论
1小时0条评论7月29日消息 - 前沿医学资讯网据悉,Affymax和武田全球研发中心宣布,美国FDA接受peginesatide(以前称为Hematide)用于治疗透析的慢性肾脏病(CKD)成人患者贫血的新药申请(NDA)的审查。 如果获得批准,peginesatide将是美国第一个用于治疗接受透析的CKD...
-
FDA批准TM-400孤儿药设计
环球医学资讯

 1小时0条评论
1小时0条评论7月29日消息 - 前沿医学资讯网据悉,美国食品和药物管理局(FDA)已批准了TikoMed AB的TM-400孤儿药设计,该药用于干细胞移植治疗之前的干细胞活化。 TM-400正在研究中,该药通过增加可移植细胞的数量进而提高植入的成功率和患者的预后,从而改善造血干细胞...
-
FDA批准血液稀释药Brilinta用于治疗急性冠脉综合征
环球医学资讯

 1小时0条评论
1小时0条评论7月21日消息 - 前沿医学资讯网据FDA网站报道,7月20日,美国食品和药物管理局(FDA)批准血液稀释药物BRILINTA(替卡格雷)用于减少急性冠脉综合征(ACS)患者的心血管死亡和心脏病发作。 ACS包括引起一系列症状的多种疾病,如不稳定型心绞痛或心脏病发作,...
-
FDA批准审查卫材公司DACOGEN的补充新药申请
环球医学资讯

 1小时0条评论
1小时0条评论7月15日消息 - 前沿医学资讯网据News-Medical.Net报道,致力于发现和开发新的癌症疗法的制药公司SuperGen公司(纳斯达克:SUPG)宣布,卫材公司日前公布的资料显示,美国食品和药物管理局(FDA)已经接受审查其DACOGEN ®(地西他滨)的补充新药申请(sNDA)...
-
FDA批准了一项白血病测试
环球医学资讯

 1小时0条评论
1小时0条评论8月24日消息 - 前沿医学资讯网据悉,雅培公司表示,食品和药品管理局批准了一项可以帮助确定慢性淋巴细胞白血病(CLL)患者预后的基因测试。 雅培的VysisCLL荧光染色体原位杂交探针试剂盒可检测淋巴细胞的基因异常,淋巴细胞是一种帮助抵抗感染的白细胞。慢...
-
24年来FDA批准首个用于治疗两种类型淋巴瘤的药物
环球医学资讯

 1小时0条评论
1小时0条评论8月22日消息 - 前沿医学资讯网据悉,近日,美国食品和药物管理局批准Adcetris用于治疗霍奇金淋巴瘤(HL)和一种被称为系统性间变性大细胞淋巴瘤(ALCL)的罕见淋巴瘤。 淋巴瘤是淋巴系统的癌症。Adcetris是一种可结合抗体和药物的抗体药物共轭物,可使抗体直...
-
FDA批准Corifact治疗先天性凝血因子XIII缺乏症
环球医学资讯

 1小时0条评论
1小时0条评论2月23日消息 - 前沿医学资讯网据悉,杰特贝林公司研制的首个用于预防罕见的基因缺陷病先天性凝血因子XIII缺乏症患者出血症的产品Corifact获得了美国FDA批准。 凝血因子XIII是一种存在于血液循环并参与正常凝血过程的重要物质。先天性凝血因子XIII缺乏症患者...
-
FDA指定SL-401作为孤儿药治疗急性髓性白血病
环球医学资讯

 1小时0条评论
1小时0条评论3月15日消息 - 前沿医学资讯网据THE MEDICAL NEWS网站报道,ShareStemline医疗公司近日宣布,该公司的先导化合物SL-401已被美国食品和药物管理局(FDA)指定为孤儿药,用于治疗急性髓性白血病(AML)。 在AML患者中开展的SL-401多中心I / II期临床试验已完...
-
阿斯利康回应FDA对替卡格雷的质疑
环球医学资讯

 1小时0条评论
1小时0条评论1月24日消息 - 前沿医学资讯网据悉,阿斯利康公司近日宣布,该公司已经对美国食品和药品管理局(FDA)关于其新的抗血小板制剂—替卡格雷(Brilinta)的质疑做出了回应,并表示对该药物将获得美国批准充满信心。 2010年7月,替卡格雷由美国FDA咨询小组推荐批...
-
FDA:新的红细胞生成刺激药物剂量准则
环球医学资讯

 1小时0条评论
1小时0条评论6月27日消息 - 前沿医学资讯网据悉,美国食品和药物管理局(FDA)6月24日宣布,当使用红细胞生成刺激药(ESAs)来治疗慢性肾脏病(CKD)患者的贫血时,应使用更为保守的剂量准则。 药物评价和研究中心血液科产品部门安全性副主任Robert C. Kane博士在在一个电...
-
FDA重度出血研讨会讨论了对有效局部止血药的需求
环球医学资讯

 1小时0条评论
1小时0条评论12月28日消息 - 专家小组成员在近期的一次FDA重度出血研讨会上表示,目前亟需有效的局部止血药以处理创伤和手术时发生的重度出血,并探讨了一组在设计严谨的试验中研究药品疗效时应该采用的主要临床终点。 此次研讨会的目的在于召集创伤领域的学术、医学和科...
-
FDA:免疫性血小板减少性紫癜患者慎用免疫球蛋白制…
环球医学资讯

 1小时0条评论
1小时0条评论3月14日消息 - 2010年3月10日,美国食品药品管理局(FDA)就使用WinRho SDF(一种人体静脉注射用免疫球蛋白)相关的安全性问题向医护人员发布了一则通告。 在使用WinRho SDF治疗免疫性血小板减少性紫癜(ITP)患者中已经有发生血管内溶血(IVH)和死亡等并发症的病例...
-
骨髓增生异常综合征治疗药Dacogen的新治疗方案获得F…
环球医学资讯

 1小时0条评论
1小时0条评论3月24日消息 - 11日,卫材药业有限公司(Eisai Inc)宣布,美国食品药品管理局已批准Dacogen(地西他滨)治疗骨髓增生异常综合症(MDS)的5天给药方案。在新方案中,Dacogen的剂量为20 mg/m2,持续静脉(IV)滴注,滴注时间为1 h,每天重复一次,5天为一个周期。此周期每...
-
FDA要求抗凝血药波立维添加加框警告
环球医学资讯

 1小时0条评论
1小时0条评论3月14日消息 - 美国食品和药物管理局本周发出警告,称抗凝血药波立维(氯吡格雷)对代谢不佳人群效果有限,因此必须在药品标签上添加加框警告。 波立维是赛诺菲-安万特和百时美施贵宝两家公司研制的抗血小板凝集药物,具有不可逆的血小板抑制作用,可以减少...
-
Rituxan(利妥昔单抗)对于慢性淋巴细胞白血病的疗…
环球医学资讯

 1小时0条评论
1小时0条评论11月20日消息 - 基因泰克公司和Biogen Idec今天宣布FDA已经批准Rituxan与氟达拉滨、环磷腺苷三者联合治疗已经接受或者尚未接受过治疗的慢性淋巴细胞白血病患者。 FDA没有进一步要求新的数据来完成评审。基因泰克和Biogen Idec表示会进一步完善药物标签。 ...
-
Octapharma获得FDA批准和wilate(R) 罕见病药物的独…
环球医学资讯

 1小时0条评论
1小时0条评论1月14日消息 - 全球最大的血浆制品制造商之一Octapharma AG 今天宣布,该公司已经获得了美国食品和药物管理局 (FDA) 授予的 wilate(R) 罕见病药物独家授权。这项授权指定将 wilate(R) 用于重度血管性血友病 (VWD) 患者的自发性或创伤引起的出血治疗,以及某些已...
-
SFDA责令召回某公司亚砷酸氯化钠注射液
环球医学资讯

 1小时0条评论
1小时0条评论8月13日消息 - SFDA 8月5日发布信息,8月4日,黑龙江省食品药品监督管理局发现哈尔滨医大药业有限公司生产的亚砷酸氯化钠注射液(规格10 ml:10 mg)存在标签标示问题,批号为20090901的部分产品标示规格与实际装量不符。黑龙江省食品药品监督管理局已责令上述公...
-
美国FDA扩大放免治疗制剂Zevalin治疗非霍奇金淋巴瘤…
环球医学资讯

 1小时0条评论
1小时0条评论9月16日消息 - 光谱制药公司(Spectrum Pharmaceuticals)在2009年9月4日宣布已收到美国食品药品管理局(FDA)的批件,允许扩大Zevalin(商品名:泽娃灵;通用名:替伊莫单抗)的适应证范围。Zevalin获准用于经一线化疗后部分缓解或完全缓解的滤泡型非霍奇金淋巴...
-
FDA发布关于铁鳌合剂Exjade安全性的早期沟通信息
环球医学资讯

 1小时0条评论
1小时0条评论2009年10月14日消息 - 美国食品药品管理局(FDA)于2009年9月25日发布了一项关于正在进行的Exjade(deferasirox)安全问题审查的早期沟通信息。与无骨髓增生异常综合征(MDS)的Exjade使用者相比,罹患MDS的Exjade使用者发生肾衰、胃肠道出血(可能是致命性出血...
-
FDA加快对诺华白血病新药审批
环球医学资讯

 1小时0条评论
1小时0条评论2月21日消息 - 诺华制药声称,19日新生产的白血病用药Tasigna获得了联邦食品和药品管理局的优先审批。 此次优先审批安排加快了通常的药品审批速度,通常情况下为10个月,此次缩短了4个月,只需6个月。 总部设在瑞士的诺华称,如果获得管理局的通过,其所...
-
SFDA提醒医务人员等关注苯佐卡因引起的高铁血红蛋白…
环球医学资讯

 1小时0条评论
1小时0条评论7月14日消息 - 从国家食品药品监督管理局(SFDA)网站获悉,日前国家药品不良反应监测中心发布了第39期《药品不良反应信息通报》并表示,国外药品管理部门近期发现苯佐卡因可能引起高铁血红蛋白血症的严重不良反应。 SFDA考虑到,在我国临床应用中也同样存在...
-
SFDA:尼美舒利禁用于12岁以下儿童
环球医学资讯

 1小时0条评论
1小时0条评论5月24日消息 - 近日,据国家食品药品监督管理局(SFDA)表示,决定采取进一步措施加强尼美舒利口服制剂的使用管理。 尼美舒利是非甾体抗炎药,具有抗炎、镇痛、解热作用。最早于1985年在意大利上市。1997年在我国上市。目前,在欧洲(16个欧盟成员国)、美洲...
-
SFDA:“都可喜”被撤市
环球医学资讯

 1小时0条评论
1小时0条评论5月24日消息 - 据国家食品药品监督管理局(SFDA)网站消息,日前国家食品药品监督管理局下发通知,决定停止阿米三嗪萝巴新片在我国的生产、销售和使用,撤销其批准证明文件。 通知要求,各省(区、市)食品药品监督管理部门立即将上述决定通知辖区内有关药品生...
-
异维A酸制剂说明书FDA作出修订
环球医学资讯

 1小时0条评论
1小时0条评论2月14日消息 -来自国家食品药品监督管理局网站2月12日的消息,根据不良反应评估结果,为控制药品使用风险,国家食品药品监督管理局决定对异维A酸制剂的说明书进行修订。 此次修订的说明书仅包括异维A酸口服制剂。 国家食品药品监督管理局要求各省(区、...
-
SFDA推进保健食品化妆品审批制度改革
环球医学资讯

 1小时0条评论
1小时0条评论2月23日消息 - 前沿医学资讯网据悉,2月22日,全国保健食品化妆品监督管理工作会议在海口召开。国家食品药品监督管理局副局长边振甲会上指出,2011年国家食品药品监督管理局要以落实责任、提高效率为重点,继续积极推进保健食品化妆品审评审批制度改革。 边...
-
SFDA印发保健食品注册申报资料项目要求补充规定
环球医学资讯

 1小时0条评论
1小时0条评论1月18日消息 - 根据《食品安全法》及其实施条例对保健食品实行严格监管的要求,国家食品药品监督管理局(SFDA)组织制定了《保健食品注册申报资料项目要求补充规定》并于日前印发,要求各省、自治区、直辖市食品药品监督管理局(药品监督管理局)遵照执行,其旨...
-
SFDA:严禁医疗机构购进使用未经批准的药品和医疗器械
环球医学资讯

 1小时0条评论
1小时0条评论10月19日消息 - 日前,上海市第一人民医院发生了由于使用个人私自携带入境未经国家食品药品监督管理部门批准的药品后引起患者眼部不适的事件。为维护人民群众的生命健康,保障公众用药安全,避免类似事件的发生,按照《药品管理法》、《药品管理法实施条例》、《...
-
SFDA:有源医疗器械分类目录修订及实施工作研讨会
环球医学资讯

 1小时0条评论
1小时0条评论10月28日消息 - 10月26日,国家食品药品监督管理局医疗器械监管司组织召开部分有源医疗器械分类目录修订及实施工作研讨会,针对医用超声仪器及有关设备、医用X射线设备等有源医疗器械分类子目录修订文本以及修订发布后实施相关问题进行了研讨,预计在进一步修改...
-
FDA高管称:强生存在“系统性”质量问题
环球医学资讯

 1小时0条评论
1小时0条评论5月31日消息 - 据国外媒体报道,众议院监管及政府改革委员会周四召开针对强生制药上个月儿童用药物大面积召回事件的听证会,美国联邦食品和药物管理局(FDA)高管在听证会上作证称,强生制药及其麦克尼尔(McNeil)消费者部门的质量问题是“系统性的”。 联...
-
FDA:召回Aisys和Avance麻醉系统
环球医学资讯

 1小时0条评论
1小时0条评论5月25日消息 - 近日,通用电器(GE)医疗公司和美国食品与药物管理局(FDA)联合发布I级召回通告,召回该公司特定批次的Aisys和Avance麻醉系统。通告称,被召回的麻醉系统控制板存在缺陷,可能导致机器意外关机,停止通气、麻醉药物输送甚至患者监测。据悉,Aisy...
-
SFDA鼓励中药注射剂联合研究模式
环球医学资讯

 1小时0条评论
1小时0条评论5月13日消息 - 中药注射剂安全性再评价正处在一个最为纠结的阶段,当前跟中药注射剂相关的大小动静,都让企业绷紧了心中的弦。 不久前由中国中药协会主办、北京康派特医药经济技术研究中心承办的中药注射剂安全性再评价政策趋势及技术标准研讨会,其场面火爆...
-
SFDA公布2009年国家药品不良反应监测年度报告
环球医学资讯

 1小时0条评论
1小时0条评论4月23日消息 - 药品不良反应是指合格药品在正常用法用量下出现的与用药目的无关的有害反应。 为加强上市后药品监测与评价,维护公众用药安全,依据《药品不良反应报告和监测管理办法》,国家食品药品监督管理局对2009年药品不良反应报告进行了总结分析,并首...
-
FDA重点关注仿制药质量
环球医学资讯

 1小时0条评论
1小时0条评论4月27日消息 - 美国联邦监管机构对仿制药的质量再次亮起红灯。日前,针对一家仿制药生产企业出现的生产违规问题,FDA向对方发出警告函。 加强监控增加信任度 美国FDA日前在网站上公布的信函列举了加拿大最大的制药企业Apotex公司存在的各种细节问题。比...
-
SFDA发布药物致癌试验必要性的技术指导原则
环球医学资讯

 1小时0条评论
1小时0条评论4月14日消息 - 根据《药品注册管理办法》,为指导药物研究开发,国家食品药品监督管理局(SFDA)组织制定了《药物致癌试验必要性的技术指导原则》,并于日前印发。该《指导原则》阐述了何种情况下需要进行药物致癌试验,以避免实验动物资源、人力资源和物力资源的...
-
SFDA通报 “问题人用狂犬病疫苗”检测结果
环球医学资讯

 1小时0条评论
1小时0条评论4月14日消息 - 4月2日,国家食品药品监督管理 局(SFDA)通报了江苏延申生物科技股份有限公司(以下简称“延申公司”)和河北福尔生物制药股份有限公司(以下简称“福尔公司”)生产的“问题人用狂犬病疫苗”的检测结果。 据介绍,2009年12月SFDA通报了延...
-
HHS开放政府计划包括开设新的FDA、CMS网站
环球医学资讯

 1小时0条评论
1小时0条评论4月13日消息 - 美国卫生与公众服务部(HHS)昨天公布了其开放政府计划。该计划围绕以下原则制定:增加信息透明度、鼓励公众参与HHS活动以及加强地方、州和国家政府部门之间的合作。 HHS目前正向各界征求关于该计划(1 www.hhs.gov/open)的意见。HHS首席技术官To...
-
SFDA明确骨水泥套管组件和椎体扩张器械管理类别
环球医学资讯

 1小时0条评论
1小时0条评论4月14日消息 - 为进一步加强对骨水泥套管组件和椎体扩张(成形)器械的监管,保障相关产品的安全和有效,经研究,国家食品药品监督管理局(SFDA)对骨水泥套管组件和椎体扩张(成形)器械的管理分别进行了类别明确如下: 一、骨水泥枪,或称骨水泥注入器、骨水...
-
FDA实施药品安全使用行动并发布新的药品剂量指导原则
环球医学资讯

 1小时0条评论
1小时0条评论12月18日消息 - 美国FDA近日宣布启动药品安全使用行动计划,旨在降低和防止药害事故的发生。据悉,每年大约有数百万人因不合理使用药物而致药害损伤,许多药害事故的发生是由于对药品及患者情况等信息了解不够所引起,还有一些可避免的药害包括无意识的药物误用...
-
FDA新药批准数保持增长
环球医学资讯

 1小时0条评论
1小时0条评论1月21日消息 - 日前,美国食品与药物管理局(FDA)表示,2009年批准的新药数量基本与2008年持平,表明在药品安全方面的收紧措施并没有降低药品上市速度。在过去1年里,FDA的新任官员针对药品安全问题提出不少警告,并对一些违反安全规定的公司给予了警告处理。 ...
-
FDA要求玻璃体内植入体Iluvien的新药上市申请提交更…
环球医学资讯

 1小时0条评论
1小时0条评论11月16日消息 - 环球医学据悉,美国食品与药品管理局(FDA)在本月11日给Alimera Sciences公司发了完整回应信,称不能批准Iluvien的新药上市申请(NDA),因为NDA没有提供足够数据支持该药对于治疗DME患者是安全有效的。该公司需作更多研究才可使释放激素氟轻松...
-
FDA对手机APP医疗应用软件进行监管
环球医学资讯

 1小时0条评论
1小时0条评论7月20日消息 -美国食品和药品管理署(FDA)周二首次对手机和其它手持设备中的迅速扩大的医疗应用APP软件进行监管和测量。 随着iPhone和Android系统智能手机等其它移动设备设计的“健康系统”开始泛滥,分析师预计市场中存在的移动设备医疗应用功能已经超过了1....
-
FDA批准首个陶瓷与金属全髋关节置换系统
环球医学资讯

 1小时0条评论
1小时0条评论6月17日消息 - 6月13日,美国FDA批准了第一个人工陶瓷与金属全髋关节系统,用于骨关节炎患者的治疗。 髋关节由球形的股骨头和髋臼组成。在全髋关节置换术中,骨与软骨磨损的部分被取出,用人工髋关节替代。 以前FDA批准的全髋关节置换系统,使用了金属、...
-
XIENCE nano获美FDA批准用于冠状动脉小血管疾病
环球医学资讯

 1小时0条评论
1小时0条评论5月30日消息 - 前沿医学资讯网据悉,雅培公司近日宣布,依维莫司冠状动脉洗脱支架系统XIENCE nano已经获得美国FDA批准用于治疗冠状动脉小血管疾病。XIENCE nano采用与XIENCE V依维莫司冠状动脉洗脱支架系统相同的平台,为美国医生在2.25毫米直径大小的冠状动脉小...
-
FDA批准自体细胞疗法laViv用于微笑线美容
环球医学资讯

 1小时0条评论
1小时0条评论6月28日消息 - 2011年6月22日,Fibrocell Science公司宣布美国食品药品管理局(FDA)已批准laViv (azficel-T)用于改善成人中重度鼻唇沟皱纹(微笑线)的美观程度。laViv是一种个体化美学细胞疗法,其专利技术是提取患者本人生成胶原的皮肤细胞——成纤维细胞并进行增...
-
治疗大脑动脉瘤的新方法获美国FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论4月15日消息 - 前沿医学资讯网据悉,美国食品药品管理局(FDA)已批准将cPAX动脉瘤治疗系统用于因大小和形状所致的难治性脑动脉瘤的手术。 动脉瘤是血管壁中的凸出部分,变大时会破裂,造成出血或死亡。脑动脉瘤通常无症状,直至其生长压迫大脑神经或开始渗...
-
FDA专家小组支持Lap-Band用于肥胖病情较轻的患者
环球医学资讯

 1小时0条评论
1小时0条评论12月13日消息 - FDA专家小组赞成批准扩大Allergan开发的Lap-Band 外科肥胖治疗装置的适用范围,这意味着又有2,700万肥胖者可以选择接受这种手术。 Allergan通过补充上市前申请程序希望扩大这种可调式胃束带装置标注的适应证范围,将肥胖程度较轻以及不一定会...
-
RSNA:FDA批准锐珂公司的CR乳腺放射成像系统
环球医学资讯

 1小时0条评论
1小时0条评论11月17日消息 - 锐珂医疗公司(罗切斯特,纽约)的高分辨率计算机乳腺放射成像(CR)系统获得了美国食品和药物管理局(FDA)的批准函。 锐珂的DirectView乳腺放射成像功能允许使用者用数字化的方式获取乳腺放射影像,同时仍然能够利用医疗保健机构现有的乳腺成像...
-
FDA批准雅培第四代革命性艾滋病检测试剂盒
环球医学资讯

 1小时0条评论
1小时0条评论8月31日消息 - 美国食品和药物管理局(FDA)近日批准了雅培研发的革命性艾滋病诊断工具ARCHITECT HIV Ag/Ab Combo检验试剂盒。它将帮助医生更早确诊艾滋病患者,从而赢得治疗时间。 据了解,该检测试剂盒能同时检测HIV抗原和抗体。HIV抗原是感染HIV病毒后立...
-
高敏感HIV检测试剂盒获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论6月22日消息 - 前沿医学资讯网据FDA官方网站报道,其6月21日批准了首个可同时检测人类免疫缺陷病毒(HIV)抗原和抗体的检测试剂盒。该检测试剂盒批准用于帮助诊断包括怀孕妇女在内的成人HIV-1/HIV-2感染者。这也是首个用于帮助两岁儿童HIV-1/HIV-2感染诊断的检...
-
美国FDA澄清:将允许继续使用Simplexa甲型H1N1流感…
环球医学资讯

 1小时0条评论
1小时0条评论5月26日消息 - 前沿医药资讯网从美国FDA网站获悉,美国FDA于24日宣布,其对Simplexa甲型H1N1流感(2009年)检验——一项针对有呼吸道感染体征和症状患者的2009 H1N1流感病毒测试做出了澄清。 到这次澄清为止,只有通过一项应急使用授权(EUA)才能进行2009 H...
-
雅培第四代艾滋病检测试剂盒获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论8月25日消息 - 美国食品和药物管理局FDA近日批准了雅培研发的革命性艾滋病诊断工具——ARCHITECT HIV Ag/Ab Combo检验试剂盒。它将帮助医生更早确诊艾滋病患者,从而赢得治疗时间。 该检测试剂盒能同时检测HIV抗原和抗体。HIV抗原是感染HIV病毒后立即产生的...
-
FDA指出药物输液泵存在安全问题
环球医学资讯

 1小时0条评论
1小时0条评论4月28日消息 - 前沿医药资讯网据国外媒体报道,在医院和家庭使用的输送给患者药物和营养物质的输液泵是持久安全性问题的一个根源,这促使美国食品和药物管理局(FDA)关注这些内容,卫生部官员4月23日说。 在过去5年来,FDA已收到超过56,000份有关这些输液泵...
-
射频装置用于治疗严重慢性哮喘获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论4月30日消息 - 前沿医药资讯网据国外媒体报道,第一个使用射频能量用于控制重度慢性哮喘成年人肺部炎症的装置已经获得美国FDA批准。 Alair Bronchial Thermoplasty系统适用于18岁以上的药物(包括吸入皮质类固醇或长效β受体激动剂)不能控制的哮喘患者。 ...
-
FDA将重新考虑放疗设备的上市前批准程序
环球医学资讯

 1小时0条评论
1小时0条评论4月16日消息 - 美国食品药品管理局(FDA)希望通过重新考虑某些放疗设备的上市前批准策略以减少放疗时出现剂量错误和照射野不准的问题。 FDA器械和放射健康中心(CDRH)负责人Jeffrey Shuren于4月8日致信直线加速器、放疗计划系统及辅助设备(如放疗模拟器)的生产...
-
300万像素显示器获得FDA 510认证
环球医学资讯

 1小时0条评论
1小时0条评论9月25日消息 - 东京特殊电线公司的数字乳腺X线摄影装置(Mammography)用21.3英寸单色液晶显示器“MS31i2”已获得FDA (美国食品及药品管理局)的510(k)认证。获得510(k)认证就意味着,该显示器在美国作为数字乳腺X线摄影装置用设备销售时,FDA承认其相关安全性...
-
FDA批准3种除颤器新适应证
环球医学资讯

 1小时0条评论
1小时0条评论9月21日消息 - 9月16日,美国FDA通过了3种心脏再同步化治疗除颤器(CRT-D)用于治疗特殊心力衰竭(心衰)患者的新适应证。新的用途是治疗左束支传导阻滞患者。这3种器械均由波士顿科学公司生产,旨在治疗轻度心衰或无明显症状心衰患者的左束支传导阻滞。 CR...
-
美国FDA批准首个经皮心脏瓣膜上市
环球医学资讯

 1小时0条评论
1小时0条评论1月28日消息 - 美国食品和药物管理局已经批准美敦力公司的Melody经皮心脏瓣膜和系统递药系统上市,Melody是第一个从腿部血管通过导管移植的心脏瓣膜。这种治疗方法可延缓先前植入肺动脉瓣conduits,并且功能不良的成人和儿童对开胸手术的需要。 Conduits是用...
-
美国FDA批准CRT - D用于心力衰竭患者
环球医学资讯

 1小时0条评论
1小时0条评论9月17日消息 - 前沿医学资讯网据美国FDA网站报道,美国FDA16日批准了心脏再同步治疗除颤器(CRT - D)的一项新适应症即用于治疗某些心脏衰竭患者。新用途就是用于左束支传导阻滞患者。这3项装置全部由波士顿科学公司制造,是为了治疗左束支传导阻滞伴有轻度心脏...
-
FDA更新戒烟药瓦伦尼克林的标签信息
环球医学资讯

 1小时0条评论
1小时0条评论7月26日消息 - 前沿医学资讯网据Medscape报道,美国食品和药物管理局(FDA)已更新瓦伦尼克林的标签,包括该戒烟药新的安全性和有效性信息。 具体来说,该标签警告医生,尽管瓦伦尼克林可有效帮助心血管疾病患者戒烟,但其与轻微增加这些患者人群心血管不良...
-
FDA宣称没有证据表明戒烟药Chantix与精神疾病的发生…
环球医学资讯

 1小时0条评论
1小时0条评论10月26日消息 - 环球医学据悉,美国食品和药物管理局日前透露了两项独立研究的结果,这两项研究旨在调查关于辉瑞公司的戒烟药Chantix会增加精神疾病发生的报告。FDA称,这些研究并没有显示使用Chantix会比使用尼古丁贴片造成更多的精神问题。 曾有报道称,使...
-
Reddy博士实验室研制的磺达肝素钠注射液获USFDA批准
环球医学资讯

 1小时0条评论
1小时0条评论7月18日消息 - 前沿医学资讯网据Medindia.net报道,Reddy博士实验室的磺达肝素钠注射液的简略新药申请(ANDA)已获得美国食品和药物管理局(USFDA)的最终批准,而磺达肝素钠注射液是在美国上市的Arixtra的一种生物等效性仿制药制剂。Reddy'博士实验室和澳大利亚...
-
FDA批准美洲锥虫病药物试验
环球医学资讯

 1小时0条评论
1小时0条评论11月23日消息 - 环球医学据悉,雅培公司表示,美国食品和药物管理局(FDA)批准了其对美洲锥虫病血液样本进行的药物试验。南美锥虫病是常见于中美洲和南美洲的一种传染病。 美洲锥虫病是通过接触被感染的锥蝽臭虫的粪便而传染的,锥蝽臭虫也被称为“猎蝽”。...
-
FDA宣称没有证据表明戒烟药Chantix与精神疾病的发生…
环球医学资讯

 1小时0条评论
1小时0条评论10月26日消息 - 环球医学据悉,美国食品和药物管理局日前透露了两项独立研究的结果,这两项研究旨在调查关于辉瑞公司的戒烟药Chantix会增加精神疾病发生的报告。FDA称,这些研究并没有显示使用Chantix会比使用尼古丁贴片造成更多的精神问题。 曾有报道称,使...
-
FDA批准用于婴儿的得每通特定剂量
环球医学资讯

 1小时0条评论
1小时0条评论6月17日消息 - 前沿医学资讯网据悉, 位于美国伊利诺伊州芝加哥北部的雅培制药公司宣布,FDA批准了得每通胶囊的一个婴儿特定剂量,这个药有助于囊性纤维化患者消化食物。 该公司表示,新的剂量将会使家长和医疗护理者在每次喂养时提供准确的量,而不是打开大...
-
FDA规划今后监管科学的发展方向
环球医学资讯

 1小时0条评论
1小时0条评论8月25日消息 - 据FDA 8月17日公布的战略规划显示,FDA计划从8个主要方面来发展监管科学,包括改进创新技术和新生产方法的评审工具。 这份规划呼吁“对产品开发和评价中用到的科学技术进行彻底的现代化改革。” 这份监管科学战略规划详细阐述了FDA于去年1...
-
FDA警告消费者停止使用Soladek维生素溶液
环球医学资讯

 1小时0条评论
1小时0条评论3月30日消息 - 前沿医学资讯网据悉,近日,美国食品和药品管理局警告消费者停止使用Soladek,这种维生素溶液产品由Indo Pharma销售,原因为该产品的维生素A和D含量可能严重超标。 Soladek上市时声称,此产品适用于维生素缺乏症、佝偻病,生长期、生齿期、哺...
-
FDA专家组为Restylane的丰唇效果竖起大拇指
环球医学资讯

 1小时0条评论
1小时0条评论4月29日消息 - 前沿医学资讯网据悉,美国食品和药品管理局(FDA)医疗设备顾问委员会的综合整形外科装备专家组于本月27日推荐可注射用的皱纹填充物Restylane用作丰唇用品。 专家组投票6﹕0,其中1票弃权,认为Restylane在用作丰唇目的时通常是安全有效的,且...
-
FDA批准DaTscan用于帕金森综合征的鉴别诊断
环球医学资讯

 1小时0条评论
1小时0条评论1月18日消息 - 前沿医学资讯网据悉,近日,全球医疗保健公司GE医疗集团宣布,美国FDA已经批准了DaTscan用于检测帕金森综合征(PS)疑似成年患者大脑内的多巴胺转运蛋白(DaT),DaTscan为一种用于单光子发射计算机断层显像(SPECT)成像的放射性药剂。这是首个获得...
-
FDA批准了可防止滥用的止痛药Oxecta
环球医学资讯

 1小时0条评论
1小时0条评论6月21日消息 - 前沿医学资讯网据悉, 辉瑞公司和Acura制药公司宣布,美国食品和药物管理局(FDA)批准了一个强效的止痛药,该止痛药是设计为难以被滥用的。 FDA批准了Oxecta作为一种立即释放治疗急性或中度至重度疼痛的新药的上市。该药物也含有尼克酸,如果...
-
FDA警告采用特布他林防治早产有危险
环球医学资讯

 1小时0条评论
1小时0条评论2月24日消息 - 2011年2月17日,美国食品药品管理局(FDA)警告称,在医院或门诊机构,医生切勿对孕妇使用特布他林注射液来预防早产或长时间(超过48~72 h)治疗早产,因为该药可能会使母亲发生严重的心脏问题甚至死亡。FDA还警告医生切勿将口服特布他林用于早产的预...
-
美国FDA批准用于预防骨折的新型单克隆抗体类生物制…
环球医学资讯

 1小时0条评论
1小时0条评论6月18日消息 - 美国FDA近日批准一种新型单克隆抗体类生物制剂狄诺塞麦上市,主要用于预防绝经期妇女骨质疏松相关性骨折。不过,狄诺塞麦对人体各部分的免疫系统可能有多方面的负面影响。 美国食品药品管理局(FDA)近日批准了一种新的骨质疏松治疗药物上市,...
-
FDA声明:魔力咖啡“膳食补充剂”中含有万艾可样化…
环球医学资讯

 1小时0条评论
1小时0条评论6月24日消息 - 2010年6月19日,美国食品药品管理局(FDA)发布了一则通知,警告消费者切勿摄入名为“魔力咖啡”的饮品。该产品是一种速溶咖啡,以增强性功能的膳食补充剂形式销售。 FDA对魔力咖啡所做的一项分析显示,该产品中存在羟基硫基好猫西地那非(hydrox...
-
软骨伤在研治疗药rhPDGF-BB近日获得FDA肯定
环球医学资讯

 1小时0条评论
1小时0条评论8月24日消息 - 据国外制药行业网站最新报道,BioMimetic制药公司蛋白质疗法药rhPDGF-BB已被FDA指定为罕见病用药,它是一种重组人血小板源性生长因子类药物,目前暂被命名为rhPDGF-BB。 患者采用自体移植物或异体移植物对膝盖、肘关节或踝关节等部位的骨软骨...
-
美国国会众议院监督委员会就OTC召回事件开展调查 FD…
环球医学资讯

 1小时0条评论
1小时0条评论5月24日消息 - 由于强生公司的召回事件,FDA发现自己也成为了美国国会调查的对象,即便FDA在发现强生8个月接连3次召回其OTC产品之后也曾考虑过对强生采取可能的执法行动。 美国国会众议院监督和政府改革委员会(House Oversight and Government Reform Commit...
-
FDA召回泰诺林等40余批次婴幼儿非处方药
环球医学资讯

 1小时0条评论
1小时0条评论5月14日消息 - 近日,美国食品与药物管理局(FDA)和麦克尼尔(McNeil)公司联合发布通告,召回该公司在美国生产的40多个批次的儿童及婴儿滴剂 [商品名分别为泰诺林(Tylenol)、Motrin、仙特明(Zyrtec)、Benadryl]。 通告称,其中某些产品的质量可能未...
-
美国FDA2009年共批准26种新药上市
环球医学资讯

 1小时0条评论
1小时0条评论1月27日消息 - 据统计美国食品药品监督管理局2009年共批准26种新药上市,而2008年FDA共批准25种新药上市。 在新批准上市的26种新药中生物技术类药物共有7种。在药企方面,诺华制药以4种新药排在首位,强生旗下Centocor Ortho Biotech和葛兰素史克分别以两...
-
FDA警告:接受双氯芬酸钠乳胶剂治疗与幼儿接种第2剂…
环球医学资讯

 1小时0条评论
1小时0条评论12月21日消息 - 双氯芬酸钠乳胶剂可能影响肝功能 近日,美国食品与药物管理局(FDA)发布公告提醒医务工作者,患者在接受双氯芬酸钠乳胶剂(商品名:扶他林)治疗期间,其肝功能检测结果可能升高。药品生产厂家在该产品说明书中也就此增加了新的警示和注意...
-
GGI制药公司有多种通用名产品获得FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论12月31日消息 - Glenmark Generics US(GGI)制药公司出品的盐酸普拉克索片剂已获得了FDA的试批准,剂量分别包括0.125毫克、0.25毫克、0.5毫克、1毫克和1.5毫克。该药是Boehringer Ingelheim公司产品Mirapex的通用名药,有望于2010年10月份在市场上推出。 此...
-
过去10年FDA指定的罕见病治疗药数量翻番
环球医学资讯

 1小时0条评论
1小时0条评论1月26日消息 - 塔夫特药物发展研究中心(CSSDD)的一份最新研究结果显示,过去10年以来,被美国FDA指定为罕见病治疗药的产品数量翻番,从2000年-2002年期间的208种增加到2006年-2008年期间的425种。 自1983年美国《罕见病药法案》实施以来,已有2000多种产品...
-
FDA正进一步调查以确定服用二磷酸盐口服药是否与某…
环球医学资讯

 1小时0条评论
1小时0条评论3月15日消息 - 2010年3月11日,美国食品药品管理局(FDA)宣布,针对提出的服用二磷酸盐口服药可能与不典型的股骨转子下骨折风险有关的顾虑,FDA已对相关数据进行了审查。目前,FDA尚无法查出上述两者之间的关联。当局正与外部专家合作,其中包括最近成立的美国骨...
-
FDA警告公众 减肥药Alli有仿冒品
环球医学资讯

 1小时0条评论
1小时0条评论1月22日消息 - 2010年1月18日,美国食品药品管理局(FDA)召开新闻发布会,正式警告公众有一种伪造的、可能对健康有害的Alli 60mg胶囊(120粒替换装)正在面向消费者销售。Alli是FDA批准的一种非处方类减肥药,其有效成分为奥利司他(orlistat)。 Alli生产商葛兰...
-
SFDA提醒:关注骨肽和复方骨肽注射剂的安全性问题
环球医学资讯

 1小时0条评论
1小时0条评论3月17日消息 - 国家药品不良反应监测中心近期在第26期《药品不良反应信息通报》中对骨肽和复方骨肽注射剂进行了通报,国家食品药品监督管理局关注骨肽和复方注射剂的安全性问题。 国家药品不良反应监测中心通过监测发现,骨肽和复方骨肽注射剂在临床使用中的...
-
FDA建议改进CT扫描仪以防射线过量
环球医学资讯

 1小时0条评论
1小时0条评论11月12日消息 - FDA建议计算机断层摄影(CT)扫描仪的生产商改进用户信息资料和培训计划并调整部分软件或硬件原件以降低出现射线过量的几率。 FDA是在对加州数百例CT成像扫描致射线过度暴露病例进行为期1年的调查之后,于11月9日公布了上述建议。 FDA认定...
-
FDA再次审查减肥药物Qnexa
环球医学资讯

 1小时0条评论
1小时0条评论11月11日消息 - 环球医学据悉,美国FDA在Vivus公司重新提交了新药申请后,再次审查了其公司开发的减肥药——暂定名为Qnexa,这是一种每日给药一次的控释型芬特明/托吡酯。预计FDA将于明年4月做出批准决定。 2010年10月,该机构的内分泌和代谢药物顾问委员会...
-
FDA召回某品牌鞘插管器
环球医学资讯

 1小时0条评论
1小时0条评论11月11日消息 - 近日,美国考迪斯(Cordis)公司和FDA联合发布公告,在全国范围内召回所有批号的CROSSOVER鞘插管器。该鞘插管器可用于经皮穿刺入动脉或静脉的血管内诊断或治疗。在使用该产品时,可发生鞘伸缩或断裂,断裂部分脱落栓塞血管,可阻断远端血流,引起...
-
FDA召回某品牌胰岛素注射器
环球医学资讯

 1小时0条评论
1小时0条评论11月11日消息 - 美国某制药(Qualitest Pharmaceuticals)公司和FDA召回全美范围内所有批号的Accusure胰岛素注射器,因其针头可能断离,从而导致针头陷入到胰岛素药瓶内、针头退回到注射器内,甚至注射后针头留在皮肤内等情况。
-
FDA批准爱必妥用于治疗晚期头颈癌
环球医学资讯

 1小时0条评论
1小时0条评论11月10日消息 - 环球医学据悉,美国食品和药品管理局(FDA)近日批准爱必妥(Erbitux,通用名西妥昔单抗cetuximab)与化疗联用来治疗晚期(转移性)头颈癌。 与只接受化疗的患者相比,接受爱必妥与化疗联用的患者可延长生命。FDA已批准将该药用于某些类型的结...
-
FDA批准凡德他尼用于治疗晚期转移性甲状腺髓样癌
环球医学资讯

 1小时0条评论
1小时0条评论11月10日消息 - 环球医学据悉,美国食品和药品管理局(FDA)近日批准将凡德他尼(Vandetanib,商品名Caprelsa)用于晚期转移性甲状腺髓样癌的适应症。此决定是基于该药在最近公布的III期临床试验中显示出的良好效果。 据10月24日的《Journal of Clinical Onc...
-
FDA发出非诺贝特安全性通知
环球医学资讯

 1小时0条评论
1小时0条评论11月10日消息 - 环球医学据悉,美国FDA已发出一则安全性通知并更新了降胆固醇药非诺贝酸(Trilipix,雅培)的处方信息,阐明该药可能不会降低主要心血管事件的风险。这是基于ACCORD脂质试验的数据,该试验是比较联合应用非诺贝特加辛伐他汀与单独使用辛伐他汀对2...
-
FDA发表对己酸羟孕酮注射剂Makena的声明
环球医学资讯

 1小时0条评论
1小时0条评论11月10日消息 - 环球医学据悉,美国食品和药品管理局(FDA)于今年2月份批准己酸羟孕酮注射剂(Makena)用于降低既往至少有一次早产史的的早产风险。Makena获批多年前,其活性成分的合成药已经上市,患者的医生可向药剂师要求合成该药。今年3月,拥有Makena的K-...
-
TNF阻滞剂和癌症:FDA要求加强监督
环球医学资讯

 1小时0条评论
1小时0条评论11月8日消息 - 环球医学据悉,近日,美国食品和药物管理局(FDA)宣布,要求肿瘤坏死因子(TNF)-α受体阻滞剂制造商加强对这些药物安全性的监测,因为其对30岁以下的成人或儿童有潜在癌症风险。 制造商将被要求提交所有的恶性肿瘤报告,一旦有儿童和年轻成...
-
FDA批准非专利Elestat
环球医学资讯

 1小时0条评论
1小时0条评论11月7日消息 - 环球医学据悉,百利高公司称,他们现在正在出售爱力根公司的眼科药物Elestat的仿制药。 百利高公司表示,美国食品和药物管理局(FDA)批准了该公司合作伙伴PharmaForce/ Luitpold制药生产的一种仿制药物。 Elestat,或称依匹斯汀溶液,用于治...
-
FDA批准将利伐沙班用于预防房颤患者中风和全身性栓塞
环球医学资讯

 1小时0条评论
1小时0条评论11月7日消息 - 环球医学据悉,美国医生不久就可以用一种新的口服抗凝药来治疗房颤患者。本月4日,美国食品与药品管理局(FDA)宣布批准将利伐沙班(Rivaroxaban)(商品名拜瑞妥(Xarelto),拜耳/强生制)用于预防非瓣膜性房颤所致的中风和全身性栓塞。 FDA...
-
FDA批准Byetta注射剂单药治疗2型糖尿病
环球医学资讯

 1小时0条评论
1小时0条评论11月6日消息 - 2009年10月30日,Eli Lilly宣布美国食品药品管理局(FDA)已批准扩大Byetta (exenatide)注射剂的适应证。Byetta现已获准用于成年2型糖尿病患者的单药治疗,在饮食控制和运动疗法的基础上进一步改善患者的血糖控制情况。之前,该药仅获准作为联合治疗...
-
SFDA要求加强罗格列酮及其复方制剂的使用管理
环球医学资讯

 1小时0条评论
1小时0条评论11月4日消息 - 继2010年9月23日欧洲药品监督管理局(EMA)和美国食品和药物管理局(FDA)分别决定暂停和严格限制罗格列酮及其复方制剂的使用后,国家食品药品监督管理局(SFDA)于10月16日发布《药品不良反应信息通报》,要求警惕罗格列酮的心血管系统不良反应,...
-
FDA批准Amylin公司的艾赛那肽单药用于2型糖尿病的血…
环球医学资讯

 1小时0条评论
1小时0条评论<?xml:namespace prefix = st1 ns = "urn:schemas-microsoft-com:office:smarttags" />11月4日消息 - Amylin制药公司10月30日宣布,其旗舰产品艾赛那肽(Byetta,百泌达) 已获FDA批准单药用于2型糖尿病的血糖控制。在这之前,本品仅可用于使用其它糖尿病药物未获理想...
-
FDA接受了非专利利必通的简化新药申请
环球医学资讯

 1小时0条评论
1小时0条评论11月3日消息 - 环球医学据悉,Intellipharmaceutics国际公司日前宣布,美国食品和药物管理局(FDA)已经接受备案了该公司的一个仿制版本利必通XR(拉莫三嗪缓释片)的简化新药申请(ANDA),利必通XR是一种用于治疗癫痫的抗惊厥药物。据威科医疗统计,于2009年6...
-
FDA提醒谨慎应用GnRH激动剂
环球医学资讯

 1小时0条评论
1小时0条评论11月3日消息 - 2010年10月20日,美国食品与药物管理局(FDA)发布声明,要求在促性腺激素释放激素(GnRH)激动剂药品标签添加新的安全信息,提醒接受该药治疗的前列腺癌患者,其发生糖尿病和部分心血管疾病(心脏病发作、心脏性猝死、卒中)的风险升高。 FDA...
-
美国FDA批准恩替卡韦用于治疗乙型肝炎
环球医学资讯

 1小时0条评论
1小时0条评论11月2日消息 - 百时美施贵宝公司近日宣布,美国食品药品管理局(FDA)已批准核苷类似物恩替卡韦(商品名博路定)用于治疗成年失代偿性肝病患者。 本研究是一项开放式对照3b期临床试验(编号ETV-048),共纳入191例HBeAg阳性或阴性且存在失代偿性肝病症状的慢性乙型...
-
FDA授权静脉抗病毒药帕拉米韦用于某些H1N1流感病例…
环球医学资讯

 1小时0条评论
1小时0条评论11月2日消息 - 2009年10月23日,美国食品药品管理局(FDA)宣布,研发中的抗病毒药帕拉米韦已获得紧急使用授权(EUA)。该授权特别指出,2009年度H1N1流感确诊病例或疑似病例(包括某些成人及儿科患者)住院后可接受神经氨酸酶抑制剂帕拉米韦静脉用药治疗。FDA应美国疾...
-
FDA批准首个外周T细胞淋巴瘤治疗药物Folotyn上市
环球医学资讯

 1小时0条评论
1小时0条评论11月2日消息 - 美国食品药品监督管理局(FDA)9月25日批准首个治疗外周T细胞淋巴瘤(PTCL)药物pralatrexate (Folotyn) 上市。PTCL为浸润性非霍奇金淋巴瘤,在美国每年有约9500名患者发病,被确定为罕见性疾病,Folotyn被指定为孤儿药。FDA通过快速审批程序批准...
-
FDA支持Vytorin用于治疗肾脏疾病
环球医学资讯

 1小时0条评论
1小时0条评论11月1日消息 - 环球医学据悉,美国食品和药物管理局说,默克公司的降胆固醇药物Vytorin有助于减少肾脏疾病患者的心脏病发作、中风和其他相关问题,这是这一“重磅炸弹”药物的潜在新用途。 该机构的在线审查也没有发现有关Vytorin的新的安全顾虑,这一顾虑来...
-
2010年第四季度有多种药物等待美国FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论11月1日消息 - FDA将在2010年四季度完成几个重要药物的获批决定。它们分别为治疗纤维肌痛的羟丁酸钠、治疗假性球麻痹症状的AVP-923以及治疗系统性红斑狼疮的Belimumab。 羟丁酸钠 首先,根据美国《处方药申报者付费法案(PDUFA)》羟丁酸钠(rekinla;...
-
SFDA要求停止西布曲明的生产、销售和使用
环球医学资讯

 1小时0条评论
1小时0条评论11月1日消息 - 近期,国家食品药品监管局组织相关专家对西布曲明在我国使用的安全性进行了评估,并借鉴国外有关研究数据和采取的措施,认为使用西布曲明可能增加严重心血管风险,减肥治疗的风险大于效益。国家食品药品监督管理局决定停止西布曲明制剂和原料药在...
-
FDA批准用于治疗慢性阻塞性肺病的吸入气雾剂
环球医学资讯

 1小时0条评论
1小时0条评论10月10日消息 - 环球医学据悉,美国食品及药物管理局(FDA)已授予批准异丙托溴铵和沙丁胺醇吸入气雾剂(可必特肺部输药器吸入气雾剂,勃林格殷格翰)用于慢性阻塞性肺病患者,这些患者在采用常规的支气管扩张剂治疗后仍持续显示气管痉挛症状以及需要使用第二种...
-
FDA批准他达那非用于治疗良性前列腺增生
环球医学资讯

 1小时0条评论
1小时0条评论9月28日消息 - 前沿医学资讯网据悉美国食品及药品管理局(FDA)近日批准希爱力(他达拉非)用于治疗良性前列腺增生(BPH),该疾病表现为前列腺增大,同时他达那非可用于治疗BPH和ED(勃起功能障碍),ED是BPH常见并发症。早在2003年他达那非就已被批准用于治疗ED...
-
FDA批准新型血管手术应用止血凝胶
环球医学资讯

 1小时0条评论
1小时0条评论10月08日消息 - 环球医学据悉,日前,美国食品及药物管理局批准LeGoo(凝胶剂型)替代止血钳或橡皮圈用于血管手术中的暂时性止血。 在外科手术中,为了连接血管,需要暂时性中止流向附有新血管的组织的血流。止血可以有效预防过量的血液流向手术区域,降低缝...
-
FDA批准首个治疗糖尿病加高胆固醇的药物
环球医学资讯

 1小时0条评论
1小时0条评论10月8日消息 - 前沿医学资讯网据悉,默克的首个治疗糖尿病加高胆固醇的药物于10月7日获得了美国的批准,糖尿病加高胆固醇是一个可影响数百万美国人的潜在的危险组合。 食品和药物管理局(FDA)批准了药物Juvisync,它结合了默克公司的糖尿病药物Januvia和降...
-
FDA :TNF抑制剂黑框警告增加2种致命性细菌性感染的…
环球医学资讯

 1小时0条评论
1小时0条评论9月9日消息 - 前沿医学资讯网据悉,近日,美国食品和药物管理局(FDA)宣布,所有肿瘤坏死因子α(TNF -α)抑制剂的标签将被更新,警告有严重甚至是致命性的2种致病菌——军团菌和李斯特菌感染的风险。 TNF -α受体阻滞剂用于治疗风湿性关节炎 、强直性脊柱...
-
FDA授予CPI-613孤儿药地位
环球医学资讯

 1小时0条评论
1小时0条评论9月9日消息 - 前沿医学资讯网据悉,Cornerstone制药公司宣布,美国食品和药物管理局已授予CPI-613孤儿药地位,CPI-613是该公司主要的候选产品,用于治疗急性髓系白血病(AML)。 “CPI-613的孤儿药地位显著增强了其价值主张,并对推进那些只有极少数治疗方案...
-
FDA顾问小组重新评估双磷酸盐类骨质疏松症药物
环球医学资讯

 1小时0条评论
1小时0条评论9月9日消息 - 前沿医学资讯网据国外媒体报道,最近的研究显示骨质疏松症药物双磷酸盐类与大腿和下巴的脆骨症相关,目前美国食品和药物管理局(FDA)正在重新评估受欢迎的双磷酸盐类。 由美国骨与矿物质研究协会于去年9月进行的一项研究表明,双膦酸盐类增加...
-
新的手术器械跟踪技术获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论9月9日消息 - 前沿医学资讯网据biospectrumasia报道,一项可以在手术过程中追踪海绵和手术器械的新技术近日获得了美国食品及药物管理局的(FDA)批准。 位于美国的Haldor先进技术公司开发了ORLocate系统,用以提到替代医生完成复杂和费时的手术器械清点工作,...
-
SFDA曝光“痔疮净”等四种医疗器械违法广告
环球医学资讯

 1小时0条评论
1小时0条评论9月8日消息 - 从国家食品药品监督管理局(SFDA)网站获悉,日前SFDA曝光了“纳米银抗菌水凝胶系列(痔疮净)”等4种医疗器械违法广告。食品药品监督管理部门根据《医疗器械广告审查办法》对前述违法广告的医疗器械及生产企业进行了处理,同时依法移送工商行政管理...
-
新浓度的降眼压药卢美根滴眼液获得FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论9月7日消息 - 2010年8月31日,美国眼力健(Allergan)公司宣布,美国食品药品管理局(FDA)已经批准浓度为0.01%的卢美根滴眼液(Lumigan,贝美前列素滴眼液)用作降低开角型青光眼或高眼压症患者高眼压(IOP)的一线治疗。0.01%卢美根滴眼液是之前获准的0.03%卢美根滴眼...
-
美国FDA批准Zenpep用于治疗胰腺外分泌机能不全
环球医学资讯

 1小时0条评论
1小时0条评论9月7日消息 - Eurand公司在2009年8月28日宣布:美国食品药品管理局(FDA)已经批准胰脂酶Zenpep(胰腺酶制剂,PEP)缓释胶囊用于治疗囊性纤维化(CF)或其他疾病引起的胰腺外分泌机能不全(EPI)。据该公司称,Zenpep是一种高稳定性制剂,提取自猪的胰腺,其生物学特性类...
-
美国FDA近日批准抗病毒药物万赛维用于预防部分移植…
环球医学资讯

 1小时0条评论
1小时0条评论9月7日消息 - 罗氏公司在2009年8月31日宣布,美国食品药品管理局(FDA)已经批准Valcyte (商品名:万赛维;通用名:缬更昔洛韦盐酸盐)用于预防年龄在4个月到16岁小儿肾脏和心脏移植患者的巨细胞病毒(CMV)感染,此类患儿被认为是CMV感染的高危群体。此外,美国FDA...
-
慢性粒细胞白血病(CML)药物Bosulif获FDA批准
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论9月5日环球医学--据悉,本周二,健康监管机构批准了辉瑞公司的一种治疗罕见白血病药物,这使该公司在努力扩大其肿瘤业务上又迈进了一步。 该药名为Bosulif,用于治疗慢性粒细胞白血病(CML),该病是一种常见于成年人的血液和骨髓性疾病。美国食品药物管理局称,约有...
-
FDA强调骨质疏松治疗药Reclast的肾损伤警告
环球医学资讯

 1小时0条评论
1小时0条评论9月5日消息 - 前沿医学资讯网据悉,近日,据美国食品和药物管理局(FDA)宣布的标签更改信息,用于预防和治疗骨质疏松症的注射用二膦酸盐——唑来膦酸(Reclast, 诺华制药)禁止用于肌酐清除率低于35 mL/min的患者或者有急性肾功能损害证据的患者。 该修订是在...
-
FDA强调骨质疏松治疗药Reclast的肾损伤警告
环球医学资讯

 1小时0条评论
1小时0条评论9月5日消息 - 前沿医学资讯网据悉,近日,据美国食品和药物管理局(FDA)宣布的标签更改信息,用于预防和治疗骨质疏松症的注射用二膦酸盐——唑来膦酸(Reclast, 诺华制药)禁止用于肌酐清除率低于35 mL/min的患者或者有急性肾功能损害证据的患者。 该修订是在...
-
7家售假劣药品网站被SFDA曝光
环球医学资讯

 1小时0条评论
1小时0条评论9月5日消息 - 据悉,7家违法网站因发布虚假药品信息和销售假劣药品,严重危害公众安全用药,被国家食品药品监督管理局(SFDA)曝光。它们分别是: - http://www.tangniaobing120.net.cn,标示单位为“中华中医科学院糖尿病研究总院”,销售 “降糖甲胶囊”;...
-
新型便秘药物Linzess获FDA批准
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论美国食品和药物管理局(FDA)已批准一种用于治疗成人某些类型肠易激综合征的药物,这标志着该公司的第一个产品获批。 据福克斯新闻网报道,该药来自铁木制药公司,将以商品名Linzess出售,被批准用于治疗IBS便秘以及慢性特发性便秘。 Linzess是一种胶囊,要在每...
-
妥布霉素治疗囊性纤维化遭FDA质疑
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论9月3日环球医学--从美国食品药物管理局(FDA)周五在其网站上发布的文件了解到,美国药物评审家质疑Novartis的实验性吸入抗生素粉剂能够帮助囊性纤维化患者改善呼吸。 FDA在下周三举行的一项外部专家咨询会讨论该药物之前,会对Novartis吸入性粉剂妥布霉素进行评审。...
-
FDA正在评估三种新出减肥药
环球医学资讯

 1小时0条评论
1小时0条评论9月3日消息 - 美国食品药品管理局(FDA)将其顾问委员会评估3种新减肥药的最终期限设定为今年年底以前,对其中两个药物的决定将在以后两个月内发出通知。 Qnexa 加拿大Vivus公司开发的Qnexa是食欲抑制剂芬特明和抗癫痫药托吡酯的固定剂量复方制剂,用于...
-
FDA批准了Hib强化疫苗
环球医学资讯

 1小时0条评论
1小时0条评论9月3日消息 - 8月19日,葛兰素史克公司和美国食品药品管理局(FDA)宣布,一种用于预防B型流感嗜血杆菌(Hib)感染的疫苗Hiberix,,已提前获得批准。Hib感染可引起脑膜炎,后者病情可呈重度,有时甚至可致死。该疫苗适合作为15月龄儿童的强化免疫,作用可持续4...
-
芬戈莫德遭遇FDA的安全通告
环球医学资讯
 环球医学编写
环球医学编写 1小时0条评论
1小时0条评论日前,欧洲一位诊断为复发型多发性硬化(MS)的患者在服用芬戈莫德(Gilenya)后出现罕见而严重的脑部感染。对此,2013年8月29日,美国食品和药物管理局(FDA)提醒市民,在没有与医疗专业人事咨询过任何疑问或疑虑时,患者不应自行停止服用芬戈莫德。 多发性硬化药...
-
FDA:重新包装贝伐单抗可引起严重眼睛问题
环球医学资讯

 1小时0条评论
1小时0条评论9月2日消息 - 前沿医学资讯网据悉,近日,美国食品和药物管理局(FDA)警告医生,在佛罗里达州迈阿密,用重新包装玻璃体内注射药物贝伐单抗治疗新生血管性或湿性年龄相关性黄斑变性,已经造成一系列严重的链球菌性眼内炎感染和失明事件。 田纳西州也出现了贝...
-
FDA警告:用扑热息痛出皮疹应立即停药
环球医学资讯
 环球医学编写
环球医学编写 1小时0条评论
1小时0条评论近期,美国食品和药品管理局(FDA)发布提示称,扑热息痛可引起罕见但严重的皮肤病,建议服用时一旦出现皮疹、皮肤出水泡或更严重的皮肤损害时,应停药就诊。同时将其不良反应预警级别提高至最高级别黑框警告。 扑热息痛引发不良反应可致人死亡,主要因为它可能引起...
-
FDA警告:孕早期长期使用大剂量大扶康可能增加出生…
环球医学资讯

 1小时0条评论
1小时0条评论8月12日消息 - 2011年8月3日,美国食品药品管理局(FDA)发布了一则有关抗真菌药大扶康(氟康唑)的安全警示。FDA警告称,在孕早期长期大剂量应用此药的女性可能会使婴儿面临一系列罕见而独特的出生缺陷的风险。治疗阴道霉菌感染(念珠菌病)所使用的单次小剂量(150 mg...
-
每日一次三合一HIV治疗药获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论8月12日消息 - 前沿医学资讯网据悉,美国食品和药物管理局(FDA)8月10日批准Complera上市,这是一种用于治疗首次HIV感染的每日一次含3种药物的复方药。 Complera是含有一种非核苷逆转录酶抑制剂(NNRTI)rilpivirine和两种核苷逆转录酶抑制剂(NRTIs)替诺...
-
FDA将于明年1月作出关于Bydureon的决定
环球医学资讯

 1小时0条评论
1小时0条评论8月12日消息 - 前沿医学资讯网据悉,美国食品和药物管理局计划于明年1月下旬之前作出关于Bydureon的决定。Bydureon是每周用药一次的糖尿病药物,关于其决定已被推迟了近一年。 开发该药物的公司--礼来公司、Amylin制药公司和Alkermes公司表示,监管部门将于...
-
SFDA:9个批次产品的益母草、开塞露不合格
环球医学资讯

 1小时0条评论
1小时0条评论8月11日消息 - 据悉,国家食品药品监督管理局(SFDA)日前发布了2011年第2期国家药品质量公告。 对氟哌啶醇制剂等17个国家基本药物品种以及苦参素注射液等4个其他制剂品种的质量抽验结果显示,抽验的21个品种2661批次产品中,有2652批次产品符合标准规定,9...
-
美国FDA批准首个依诺肝素钠注射剂的仿制药
环球医学资讯

 1小时0条评论
1小时0条评论8月9日消息 - FDA日前批准首个依诺肝素钠注射剂仿制药用于预防深度静脉血栓形成。 依诺肝素钠注射剂于1993年获批,依诺肝素钠由肝素制成,其活性成分是一种天然衍生的复杂糖分子。 为使仿制药获得FDA批准,制造商必须证明仿制药含有与品牌药物系统的活...
-
突破:中国首例中成药完成美国FDAⅡ期临床试验
环球医学资讯

 1小时0条评论
1小时0条评论8月9日消息 - 历经坎坷的中国中药国际化之路终于取得了新突破。天津市人民政府和卫生部7日在京主办了“现代中药国际化产学研联盟启动暨复方丹参滴丸美国FDAⅡ期临床试验结果报告会”,宣布复方丹参滴丸完成美国食品与药品监督管理局(FDA)Ⅱ期临床试验,并即将...
-
FDA批准首个艾滋病快速诊断试验
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论近日,美国食品和药物管理局(FDA)批准了首个快速诊断试验用于诊断HIV-1/HIV-2感染以及HIV-1 p24抗原。新的测试将有助于将HIV检测扩大到目前没有传统医疗保健设施的地区,并加速艾滋病的治疗。 本次获批的HIV-1/2抗原/抗体联合雅培测试由以色列人生产,可以检测艾滋...
-
FDA评审专家建议Riociguat用于2类肺动脉高血压的治疗
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论美国食品和药物管理局(FDA)的一个咨询委员会近日一致投票决定,建议Riociguat用于慢性栓塞性肺动脉高压(CTEPH;世界卫生组织[WHO] 分级IV)的治疗,以提高患者运动能力和改善WHO功能分类。 该委员会还投票一致建议Riociguat用于肺动脉高压(PAH;WHO分级I)的治疗...
-
FDA明确“无麸质”标注规定
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论日前,美国食品药品管理局(FDA)制订了界定食品包装上“无麸质”这一术语的规定条款,乳糜泻患者和其他采取无麸质饮食者将能够更放心地购买和使用“无麸质”食品。麸质是一种存在于小麦、大麦和黑麦中的蛋白质。据FDA介绍,如果日常饮食中含有少量麸质,多数乳糜泻...
-
FDA警示:对乙酰氨基酚或致死亡性皮疹
环球医学资讯
 环球医学编写
环球医学编写 1小时0条评论
1小时0条评论日前,美国食品药品管理局(FDA)在其官网宣布:含有对乙酰氨基酚(退热净、扑热息痛)的止疼药有可能会引发严重皮疹,或致人死亡。其有可能致命的副作用包括重症多形性红斑以及中毒性表皮坏死松解症,病情初始有流感症状,随之伴有皮痒以及皮肤表皮脱落。 FDA要求所...
-
FDA警告避免在妊娠早期重复高剂量使用氟康唑
环球医学资讯

 1小时0条评论
1小时0条评论8月4日消息 - 前沿医学资讯网据悉,8月3日,美国食品和药物管理局(FDA)警告说,在妊娠早期长期高剂量使用氟康唑(大扶康,辉瑞)(400 - 800 mg/d)可能与婴幼儿某些出生缺陷相关。 该机构强调,单次、低剂量使用氟康唑(150 mg)用于治疗阴道念珠菌病(酵母...
-
首个蝎蜇伤特异治疗药物获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论8月4日消息 - 前沿医学资讯网据悉,美国食品和药物管理局(FDA)8月3日批准Anascorp上市,该药为美国首个刺尾蝎属蝎子蛰伤特异治疗药物。 美国有毒的蝎子大多在亚利桑那州。严重蜇伤最常发生在婴儿和儿童,可引起严重的短促呼吸、肺内出现液体、呼吸困难、唾...
-
FDA:达托霉素或可引起嗜酸细胞性肺炎
环球医学资讯

 1小时0条评论
1小时0条评论8月3日消息 - 前沿医学资讯网据国外媒体报道,FDA于7月29日宣布,接受达托霉素治疗的病人可能会发生一种罕见的、严重的肺炎——嗜酸细胞性肺炎。 FDA表示,他们是在回顾了不良事件报告和期刊论文对接受达托霉素治疗的患者发生嗜酸性肺炎的描述后做出了这样的...
-
FDA批准更新多发性硬化症药物芬戈莫德的处方信息
环球医学资讯

 1小时0条评论
1小时0条评论8月3日消息 - 前沿医学资讯网据Medscape报道, 美国食品和药物管理局(FDA)已经批准多发性硬化症(MS)口服药物芬戈莫德的补充新药申请:处方信息将包括T1钆增强磁共振成像(MRI)的数据。 该补充新药申请获得批准意味着芬戈莫德的处方信息的临床研究第14节...
-
FDA专家小组赞成批准Ticagrelor 用于治疗ACS
环球医学资讯

 1小时0条评论
1小时0条评论8月2日消息 - 前沿医学资讯网据国外媒体报道,阿斯利康公司宣布,美国食品和药物管理局(FDA)的心血管和肾脏药物顾问委员会建议批准其试验药ticagrelor用于减少急性冠状动脉综合征(ACS)患者血栓事件的发生。 FDA新药申请评估顾问委员会审查了一项大型的头...
-
FDA警告勿用假冒翌晨避孕丸
环球医学资讯

 1小时0条评论
1小时0条评论8月2日消息 - 前沿医学资讯网据国外媒体报道,近日,美国食品和药物管理局(FDA)发出警告,反对使用未经批准的“翌晨避孕丸”Evital,其可能在美国销售,尤其是在一些讲西班牙语的社区。 Evital尚未在美国获批。 该警告由FDA药品评价与研究中心的药品...
-
Strides Arcolab的阿卡波糖片获美国FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论8月2日消息 - 前沿医学资讯网据悉,Strides Arcolab的25mg、50mg和100mg的阿卡波糖片已获得美国FDA批准。阿卡波糖片是一种用于治疗2型糖尿病的抗糖尿病药物。 据2011年3月IMS的数据,阿卡波糖片在整个美国市场的销售额接近2100万美元,目前市场上没有印度的...
-
FDA推迟关于Prevnar 13肺炎球菌疫苗的决定
环球医学资讯

 1小时0条评论
1小时0条评论8月2日消息 - 前沿医学资讯网据悉,辉瑞公司说,美国监管机构将再一次用3个月的时间,考虑批准其用于成人的Prevnar 13肺炎球菌疫苗。 辉瑞公司说,美国食品和药物管理局目前预计在2012年1月之前会作出决定。该机构将花时间来考虑由辉瑞公司递交的额外数据,...
-
SFDA曝光8个违法发布广告的药品及保健食品
环球医学资讯

 1小时0条评论
1小时0条评论7月11日消息 - 据悉,近日国家食品药品监督管理局(SFDA)网站发布公告,曝光了8个违法发布广告的药品、保健食品。 SFDA发布公告称,这些违法发布的药品、保健食品广告中含有不科学地表示功效的断言或保证等,严重欺骗和误导消费者。同时,公告提醒广大消费者...
-
FDA:肾移植药物belatacept的2个致命性并发症
环球医学资讯

 1小时0条评论
1小时0条评论7月8日消息 - 前沿医学资讯网据悉,近日,美国食品和药物管理局(FDA)宣布,临床医生在处方一种肾移植的药物belatacept(Nulojix,施贵宝公司)时,必须牢记2个潜在的致命性并发症,该药物6月15日被批准时已知这2个并发症。 这2个可能的并发症,一个...
-
ACCF/AHA对FDA将氯吡格雷添加黑框警告的做法给予肯定
环球医学资讯

 1小时0条评论
1小时0条评论7月8日消息 - 美国心脏病学会基金会/美国心脏学会(ACCF/AHA)发布临床声明,对美国食品与药物管理局(FDA)将抗血小板药物氯吡格雷添加黑框警告的做法给予了肯定。 该声明回顾了多项关于不同氯吡格雷剂量方案下,血小板应答及患者转归情况的小型药效学研究...
-
FDA批准新型抗凝血剂利伐沙班用于预防深静脉血栓形成
环球医学资讯

 1小时0条评论
1小时0条评论7月6日消息 - 前沿医学资讯网据悉,美国扬森制药公司宣布,美国食品和药物管理局(FDA)已批准一种新型的、每日一次口服抗凝血剂拜瑞妥(利伐沙班片)用于预防深静脉血栓形成(DVT),DVT可能导致接受膝或髋关节置换手术患者发生肺栓塞(PE)。 参与利伐沙班用...
-
FDA准备对利伐沙班用于中风/房颤进行评审
环球医学资讯

 1小时0条评论
1小时0条评论7月6日消息 - 前沿医学资讯网据悉,美国食品药物管理局(FDA)日前宣布,其心血管和肾脏药物顾问委员会将于2011年9月8日召开会议,评审利伐沙班(拜瑞妥,拜耳/强生公司)用于预防中风与非瓣膜病性房颤(AF)患者全身性栓塞的新药申请(NDA)。 据FDA的发言...
-
美国FDA顾问专家组将关注效能长达5天的紧急避孕药
环球医学资讯

 1小时0条评论
1小时0条评论7月6消息 - 美国食品药品管理局(FDA)顾问专家组将评估以下证据,即醋酸ulipristal可在无保护性交或已知(或怀疑)避孕失败120 h内作为紧急避孕剂使用的效果。 醋酸ulipristal是一种新化学实体,其作用机制与左炔诺孕酮不同,目前已获批用于紧急避孕(EC)。醋酸u...
-
Mylan制药的抗癌药Arimidex仿制版本获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论7月6日消息 - 仿制药生产商Mylan Inc(MYL)宣布,其生产的阿斯利康(AZN)抗癌药Arimidex的一个仿制版本已获得美国食品药品管理局(FDA)的批准。 该公司表示,FDA批准了1毫克剂量的anastrozole药品,后者是Arimidex的活性成分。该药被用于治疗更年期后妇女所患...
-
2010ADA:激辩FDA是否应严控降糖新药心血管安全
环球医学资讯

 1小时0条评论
1小时0条评论7月5日消息 - 降糖药物心血管安全性是糖尿病领域长期被关注的焦点,“保心”还是“降糖”成了糖尿病患者不得不面对的无奈选择。作为药物监管机构,美国食品与药品管理局(FDA)在保障糖尿病患者用药安全方面具有义不容辞的责任。 6月26日,千名参会者齐聚C...
-
Strides Acrolab宣布其多粘菌素B获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论7月4日消息 - 前沿医学资讯网据Medindia.net报道,总部位于印度班加罗尔的制药公司Strides Arcolab宣布,美国食品和药物管理局(FDA)已批准它生产抗菌药物多粘菌素B,同时其在班加罗尔的肿瘤学口服制剂设备也已获得欧洲批准。 Strides在美国市场已生产和供...
-
FDA批准每日一次支气管扩张剂用于治疗COPD
环球医学资讯

 1小时0条评论
1小时0条评论7月4日消息 - 前沿医学资讯网据悉,美国食品和药物管理局(FDA)近日批准了每日一次支气管扩张剂-茚达特罗马来酸盐(Arcapta Neohaler,诺华制药)-用于治疗慢性阻塞性肺疾病(COPD),其患者的的依从性较好,有望超过市场上现有的支气管扩张剂。 茚达特罗马...
-
FDA认定阿瓦斯丁对乳腺癌患者并非安全有效
环球医学资讯

 1小时0条评论
1小时0条评论7月1日消息 - 前沿医学资讯网据悉,在制药者申诉之后,一个顾问小组向美国食品和药物管理局确认了其先前的建议,即取消药物阿瓦斯丁用于乳腺癌的标签。 在瑞士制药巨头罗氏公司于周二开始了为期两天的要求FDA重新考虑的上诉之后,该小组以6-0的投票支持表明...
-
HGSI在研的红斑狼疮治疗新药Benlysta正待FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论6月12日消息 - 人类基因组科学公司(HGSI)近日表示,其在研的红斑狼疮治疗新药Benlysta正待通过FDA的批准,该药由HGSI和GSK携手开发。 Benlysta也名为belimumab,在向FDA递交的生物制剂许可申请内中当中,包括了该药在两项后期临床实验期间获取的数据。 ...
-
FDA限制使用剂量为80毫克的降脂药辛伐他汀
环球医学资讯

 1小时0条评论
1小时0条评论6月10日消息 - 前沿医学资讯网据悉,美国食品与药品管理局(FDA)建议医生应限制给患者处方大剂量的辛伐他汀(商品名舒降之,默沙东公司制),因为该药会使肌肉损伤风险增加。8日新发布的FDA药品安全通讯称,医生应该限制使用80mg剂量,除非患者已经服用该药为期...
-
ASCO和美国FDA推出一种网络资源以便患者获取试验用药
环球医学资讯

 1小时0条评论
1小时0条评论6月9日消息 - 美国临床肿瘤学会(ASCO)和美国食品药品管理局(FDA)在6月4日召开的联合新闻发布会上宣布,将推出一种新的网络资源以便重症患者及其医生在用尽了其他所有治疗方案而患者又没有资格参与临床试验时,申请放宽试验用药的获取途径。 作为ASCO候任主席...
-
FDA专家小组:应降低罗格列酮的使用限制
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论美国食品和药物管理局(FDA)联合咨询小组的多数投票表示,糖尿病药物罗格列酮应该留在市场上,目前的处方限制应当降低,但不能全部取消。 FDA内分泌和代谢药物咨询委员会(EMDAC)和药物安全和风险管理(DSaRM)咨询委员会的26位成员中,13位成员认为应当保留市场上...
-
肠易激综合症治疗新药阿西马朵林进入FDA快速通道
环球医学资讯

 1小时0条评论
1小时0条评论6月7日消息 - 前沿医学资讯网据悉,近日,泰奥加制药公司(Tioga Pharmaceuticals, Inc)的在研化合物阿西马朵林(Asimadoline)已获美国食品和药物管理局(FDA)批准进入快速通道,该药用于治疗腹泻型肠易激综合症(D-IBS)。 根据美国FDA注册登记的一项特...
-
拜耳含钆磁共振对比剂加乐显1.0获SFDA批准
环球医学资讯

 1小时0条评论
1小时0条评论6月7日消息 - 5月22日,拜耳医药保健有限公司宣布:含钆磁共振对比剂——加乐显1.0(钆布醇)已获得国家食品药品监督管理局的批准,并在中国正式上市。据拜耳医药保健有限公司副总裁高伦博介绍,作为新一代产品,加乐显1.0将用于颅脑和脊髓对比增强磁共振成像(MR...
-
SFDA:第二阶段非药品冒充药品专项整治行动展开
环球医学资讯

 1小时0条评论
1小时0条评论6月7日消息 - 为严厉打击非药品冒充药品违法行为,维护公众身体健康,近日,国家食品药品监管局和卫生部联合下发了《关于进一步开展整治非药品冒充药品专项行动的通知》(下简称《通知》),决定从6月至10月底,开展集中整治非药品冒充药品第二阶段专项行动。 ...
-
ASCO与FDA联合推出研究性治疗药物网络资源
环球医学资讯

 1小时0条评论
1小时0条评论6月7日消息 -- 6月4日在第46届美国临床肿瘤学会(ASCO)年会上,ASCO和美国FDA 联合宣布了一套新推出的网上资源,以帮助医生充分了解研究性治疗。 如果有科学证据显示有一种未经批准的治疗可能有益于病人,而该病人又已经用尽了所有其他的治疗方案,又...
-
FDA批准来那度胺用于治疗外套细胞淋巴瘤
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论标准治疗后复发或无效的外套细胞淋巴瘤(MCL)患者有了新的治疗选择——来那度胺。 美国食品和药品监督管理局(FDA)批准了胶囊剂型的来那度胺用于包括硼替佐米在内的两次早期治疗复发或恶化的MCL患者。 硼替佐米是官方唯一批准用于治疗MCL的药物。MCL是最...
-
FDA批准新斯的明类药物Bloxiverz上市
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论美国食品和药品监督管理局(FDA)批准新斯的明类药物Bloxiverz上市。Bloxiverz是一种胆碱酯酶抑制剂,用于扭转常规麻醉手术后神经肌肉阻断剂的影响。 Bloxiverz是FDA批准的首个新斯的明类药物。根据1938年的食品、药品和化妆品法,新斯的明是未被批准上市的第三代产...
-
FDA对PPI添加安全信息:PPI或增加髋、腕和脊椎骨折…
环球医学资讯

 1小时0条评论
1小时0条评论6月4日消息 - 美国食品与药物管理局(FDA)近日通知医务工作者和患者,其对质子泵抑制剂 ( PPI)处方和非处方(OTC)产品的标签进行了修改,添加了新的安全信息:PPI可能增加髋、腕和脊椎骨折的危险。 涉及的药物产品包括:埃索美拉唑镁肠溶片(商品名耐...
-
FDA正在审查含屈螺酮的口服避孕药致静脉血栓栓塞的…
环球医学资讯

 1小时0条评论
1小时0条评论6月2日消息 - 前沿医学资讯网据悉,美国食品和药品管理局(FDA)于5月31日宣布,其正在审查含屈螺酮的口服避孕药的安全性,评估其致静脉血栓栓塞(VTE)的风险。 4月21日在线发表在《英国医学杂志(BMJ)》的2篇文章提出了对屈螺酮在致VTE风险方面的安全性隐...
-
抗贫血药Peginesatide的上市请求已向FDA提交
环球医学资讯

 1小时0条评论
1小时0条评论6月2日消息 - 前沿医学资讯网据悉,Affymax公司及其合作伙伴武田药品工业株式会社(Takeda Pharmaceutical Co.)称,他们已经请求监管机构批准其用于改善慢性肾脏疾病患者贫血的药物Peginesatide。 这两家公司请求美国食品和药品管理局(FDA)为其候选药物Pe...
-
FDA:Baxter主动召回Hylenex
环球医学资讯

 1小时0条评论
1小时0条评论6月1日消息 - 美国食品药品管理局(FDA)于2010年5月26日宣布Baxter公司正在主动召回其生产的全部批次的Hylenex(重组透明质酸酶人用注射剂)。此次召回的原因是该公司在常规稳定性检测中发现少部分药瓶中存在颗粒样物质。经确认,这些细小的颗粒样物质是玻璃。 ...
-
SFDA批准“黄厚止泻滴丸”
环球医学资讯

 1小时0条评论
1小时0条评论6月1日消息 - 包头中药有限责任公司与广州中医药大学共同研制的国内首只复方有效部位群组方新药“黄厚止泻滴丸”,获国家食品药品监督管理局批准生产,并颁发了新药证书。 “黄厚止泻滴丸”以中医药理论为指导,进行中药有效部位群组方的新药研究探索;采用...
-
SFDA批准全新全合成奥利司他减肥胶囊
环球医学资讯

 1小时0条评论
1小时0条评论6月1日消息 - 近日,由重庆植恩药业有限公司及其下属重庆鼎联制药有限公司研发的全新全合成奥利司他减肥胶囊(赛乐西 )已获得SFDA的批准(国药准字H20103180),将由重庆华森制药有限公司生产。 奥利司他为目前国际公认的新型减肥降脂药。已经在全球100多个...
-
FDA就生物仿制药物申请的使用者付费程序征求意见
环球医学资讯

 1小时0条评论
1小时0条评论5月11日消息 - 前沿医学资讯网据悉,美国食品和药物管理局(FDA)正在就生物仿制药物和具可比性(interchangable)的生物制品申请(351(k))的使用者付费程序(User Fee Program)的制定,征求利益相关者和公众的意见。 生物制品来源于有生命的系统,如微生...
-
北京第二制药厂的非专利药苯磺酸氨氯地平获美FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论5月10日消息 - 前沿医学资讯网据悉,北京第二制药厂(BSPC)生产的降压药苯磺酸氨氯地平的简略新药申请已经获得美国食品和药物管理局(FDA)的批准。该批准代表了中国制药业发展的一个里程碑,BSPC将是第一个使其口服固体制剂药品获得美国FDA批准上市的中资制药...
-
Pixantrone新药申请再次向FDA提交
环球医学资讯

 1小时0条评论
1小时0条评论5月9日消息 - 前沿医学资讯网据悉, 细胞治疗公司(Cell Therapeutics)近日宣布,美国食品和药品管理局(FDA)的新药办公室(OND)称,基于单个对照的临床试验结果,如果下述两个关键问题能够得到满意解决,那么Pixantrone新药申请(NDA)022481号的加速审批是...
-
FDA最新监测名单:两种含对乙酰氨基酚的药品
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论美国食品和药物管理局(FDA)已将一种治疗多发性硬化症(MS)的药物和一种血液疾病药物添加到季度监控产品清单中。这两种药物都含有乙酰氨基酚,有迹象表明它们有严重风险或需要提供新的安全信息。 在2012年第四季度的FDA不良事件报告系统(FAERS)数据中,该机构收...
-
FDA批准静脉用埃索美拉唑用于治疗胃食管反流儿童患者
环球医学资讯

 1小时0条评论
1小时0条评论5月6日消息 - 前沿医学资讯网据medscape报道,美国食品和药物管理局(FDA)已经批准阿斯利康公司生产的注射用埃索美拉唑钠(Esomeprazole Sodium,商品名耐信Nexium IV),用于伴糜烂性食管炎的胃食管反流病(GERD)患儿的短期治疗。 据该公司新闻公告称,该...
-
FDA将评估右美沙芬的安全性
环球医学资讯

 1小时0条评论
1小时0条评论5月6日消息 - 由于担心感冒药成分右美沙芬的安全性,美国食品和药物管理局3日宣布,将召集外部专家对其利弊进行评估。 美国药管局当天发表声明说,美国不少青少年曾“嗑”过含有右美沙芬的感冒药,因为这一成分可以使他们产生迷幻感觉。美国毒品管制局已要求...
-
第二种筛查血液、组织以及器官捐赠者恰加斯病(Chag…
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论5月6日消息 - 前沿医药资讯网据国外媒体报道,美国FDA4月30日批准了对血液、组织和器官捐赠者进行筛查血液传播寄生虫病即恰加斯病(Chagas disease)的第二种检测方法,Chagas病是一种严重的和潜在致命的寄生虫感染,由克鲁斯氏锥虫(T. cruzi)引起。 Abbott...
-
第二种筛查血液、组织以及器官捐赠者恰加斯病(Chag…
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论5月6日消息 - 前沿医药资讯网据国外媒体报道,美国FDA4月30日批准了对血液、组织和器官捐赠者进行筛查血液传播寄生虫病即恰加斯病(Chagas disease)的第二种检测方法,Chagas病是一种严重的和潜在致命的寄生虫感染,由克鲁斯氏锥虫(T. cruzi)引起。 Abbott...
-
美国FDA就GnRH激动剂治疗前列腺癌的安全性开展评价
环球医学资讯

 1小时0条评论
1小时0条评论5月6日消息 - 美国食品药品管理局(FDA)目前正在评价促性腺激素释放激素(GnRH)激动剂是否会增加前列腺癌男性患者出现糖尿病和心血管事件的风险。 FDA在5月3日发布的声明中称,对几项试验进行的初步分析已确定使用GnRH激动剂与糖尿病、心肌梗死、卒中和猝死 “...
-
FDA批准1.62%睾酮凝胶用于治疗男性睾酮水平低下
环球医学资讯

 1小时0条评论
1小时0条评论5月4日消息 - 前沿医学资讯网据悉,雅培公司近日宣布,美国食品和药物管理局(FDA)批准其透明无味的凝胶制剂1.62%昂斯妥(AndroGel,睾酮凝胶)用于治疗睾酮水平低的男性患者。与1%昂斯妥相比,该制剂显示出以一半的首剂量即可恢复性腺机能减退男性的睾酮水平。...
-
用利拉利汀治疗II型糖尿病的新疗法获美国FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论5月4日消息 - 前沿医学资讯网据悉,美国食品和药物管理局(FDA)5月2日宣布,批准利拉利汀片(Linagliptin,商品名Tradjenta)与饮食和锻炼结合用于改善II型糖尿病成人患者的血糖控制。该药可通过阻断二肽基肽酶-4(DDP-4),使刺激饭后胰岛素分泌的激素水平升高...
-
FDA专家组否决Tivozanib用于治疗肾细胞癌
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论在顾问小组对单一设盲3期临床试验结果否定后,如果酪氨酸激酶抑制剂(TKI)tivozanib会通过认证,等待该药物的晚期肾细胞癌(RCC)患者和临床医师可能还要继续耐心等待了。 美国食品和药物管理局(FDA)的肿瘤药物咨询委员会(ODAC)以13比1拒绝了乐骋制药(Aveo Pha...
-
FDA顾问委员会建议批准Boceprevir用于治疗HCV
环球医学资讯

 1小时0条评论
1小时0条评论5月3日消息 - 前沿医学资讯网据悉,日前,默克公司(美国和加拿大以外称为默沙东——MSD)宣布,美国FDA抗病毒药顾问委员会投票一致推荐将默克公司的试验药物Boceprevir(商品名Victrelis)用于丙肝治疗。该委员会一致认为,现有的数据支持将该药联合目前的标准...
-
FDA批准在没有处方的情况下出售给15岁及以上女孩的…
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论近日,美国卫生监管部门批准紧急口服避孕药Plan B One-Step(Teva Women's Health, Inc)在没有处方的情况下出售给15岁及以上的女孩。 Plan B One-Step的有效成分是左炔诺孕酮。 美国食品和药物管理局(FDA)在一份声明中说,现在Plan B上会标有“禁止出售给15...
-
Cepheid公司检测艰难梭菌的新测试获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论4月12日消息 - 前沿医学资讯网据News-Medical.Net 报道,美国食品和药物管理局(FDA)近日声明,Cepheid Xpert C. difficile/Epi分析用于快速检测与艰难梭菌感染(CDI)相关的毒素B基因。CDI是引起腹泻的原因之一,而腹泻可致肠炎和其他严重的肠疾病,甚至可致重...
-
FDA批准新的抗孕吐药Diclegis上市
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论2013年4月8日,美国食品与药物管理局(FDA)批准了Diclegis缓释片(有效成分为多西拉敏和维他命B6)用于治疗妊娠妇女的恶心和呕吐症状。这给很多常规治疗妊娠恶心呕吐无效的妇女带来了福音。 妊娠剧吐又称孕妇晨吐。常规的治疗方法主要为分餐疗法、减少高脂易消化食...
-
美FDA批准首个治疗甲状腺髓样癌的药物Vandetanib
环球医学资讯

 1小时0条评论
1小时0条评论4月8日消息 - 前沿医学资讯网据美FDA网站报道,近日,其批准vandetanib用于治疗成年晚期甲状腺髓样癌患者,这些患者不适合手术治疗,肿瘤持续增大或引起症状。 甲状腺癌是颈部甲状腺的一种肿瘤。甲状腺髓样癌涉及的是甲状腺内特定类型的细胞,可自发性发生或...
-
FDA发布了另一种性功能增强“膳食补充剂”的警告
环球医学资讯

 1小时0条评论
1小时0条评论4月7日消息 - 前沿医药据悉,美国食品药品管理局(FDA)与Natural Wellness公司于3月30日共同向消费者发出一则警告,一种名为MasXtreme (批号为911035)的膳食补充剂,含有一定量的未申报成分爱地那非与酚妥拉明。爱地那非与阳痿处方药万艾可中的活性成分西地那非结...
-
SFDA对泡沫敷料等产品进行分类界定
环球医学资讯

 1小时0条评论
1小时0条评论4月6日消息 - 为适应医疗器械监督管理工作需要,国家食品药品监督管理局(SFDA)组织有关单位和专家对泡沫敷料等产品的管理类别进行了界定,并于日前公布了分类界定的具体内容。 泡沫敷料等产品分类界定 一、作为Ⅲ类医疗器械管理的产品 (一)泡沫敷...
-
FDA在网站公布有关“文迪雅”潜在疾病风险
环球医学资讯

 1小时0条评论
1小时0条评论4月3日消息 - 糖尿病药物“文迪雅”在被疑会引发心脏病等不良反应后,7月30日,美国食品药品监管局(FDA)顾问委员会药品专家举行有关“文迪雅”安全性的听证会。由外部专家组成的顾问委员会投票认定,虽然有证据表明“文迪雅”有增加心脏病发作的风险,但该药物...
-
新一代糖尿病药物获FDA批准
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论近日,美国食品和药物管理局(FDA)批准一种新的用于治疗成人2型糖尿病降糖药canagliflozin。 Canagliflozin是首个新一代口服钠葡萄糖协同转运蛋白2(SGLT2)抑制剂。SGLT2抑制剂可以减少肾脏葡萄糖的再吸收,增加尿中葡萄糖排泄,从而降低血浆葡萄糖水平和减轻体重...
-
Abbott向FDA提交肾脏诊断试剂上市申请
环球医学资讯

 1小时0条评论
1小时0条评论4月1日消息 - 前沿医药资讯网据国外媒体报道,雅培已向FDA提交急性肾损伤高危病人(AKI)快速诊断试剂的上市申请,美FDA同意进行审查。这种快速诊断试剂可以快速检测中性粒细胞明胶酶相关脂质运载蛋白(NGAL),而NGAL是鉴别急性肾损伤高危病人(AKI)的早期生物...
-
FDA勒令停止销售未获准的仿制硝酸甘油片
环球医学资讯

 1小时0条评论
1小时0条评论4月1日消息 - 美国食品药品管理局(FDA)于3月16日发布了一项警告,勒令Glenmark Generics和Konec Inc两大公司停止销售未获准的硝酸甘油片。 硝酸甘油片的适应证是缓解胸痛及预防心肌梗死。这类未获准的药品在剂型和说明书等一些方面与获准的硝酸甘油药品可能...
-
未被FDA批准药物的特征
环球医学资讯
 环球医学编写
环球医学编写 1小时0条评论
1小时0条评论2013年12月,在线发表在《Clin Pharmacol Ther》的一篇文章对未被FDA批准药物的特征进行回顾分析。 被美国食品药品管理局(FDA)拒绝的新药申请(NDA)经常引起争议,但关于这些决策的基础和特点尚不清楚。本研究对2007~2009年间经FDA委员会评估的新药和生物制品进...
-
56年来首个狼疮治疗药Benlysta正式获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论3月10日消息 - 前沿医学资讯网从美国食品和药物管理局网站了解到,3月9日,该局正式批准Benlysta(贝利木单抗)用于治疗活动性、自身抗体阳性并且已经接受标准治疗的狼疮(系统性红斑狼疮)患者,标准治疗包括皮质类固醇、抗疟疾药物、免疫抑制剂和非甾体抗炎药...
-
50余年首个狼疮治疗药物Benlysta有望即将获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论3月9日消息 - 前沿医学资讯网据悉,Benlysta(贝利木单抗)用于系统性红斑狼疮(SLE)治疗,本周有望获得美国食品和药物管理局(FDA)批准。这是半个世纪内使SLE患者获益药物的首次批准。制药专家们认为该药极有可能于本周四获批。 Benlysta的制造商是人类基...
-
FDA警告:新生儿避免应用洛匹那韦/利托那韦口服溶液
环球医学资讯

 1小时0条评论
1小时0条评论3月9日消息 - 前沿医学资讯网据悉,美国食品和药物管理局(FDA)近日宣布,应避免在早产儿或足月婴儿出生后头14天使用洛匹那韦/利托那韦口服溶液(Kaletra,雅培),原因是其可能导致心脏、肾脏或呼吸困难问题。FDA已经更改洛匹那韦/利托那韦口服溶液的安全标签...
-
FDA专家小组建议2013-2014年流感疫苗株
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论美国食品和药物管理局(FDA)疫苗及相关生物制品顾问委员会建议,美国2013-2014年的流感疫苗的组成应该与2012-2013的稍有不同。 在2月27日举行会议后,委员会推荐2013-2014的三价流感疫苗保留目前的疫苗株A/加利福尼亚/7/2009pdm09-类病毒。 委员会还建议,用与细胞...
-
FDA专家组将权衡胰岛素泵上市后的安全性及治疗失败…
环球医学资讯

 1小时0条评论
1小时0条评论3月8日消息 - FDA将请顾问专家组阐释召回胰岛素输液泵对患者安全性的可能影响。 FDA的普通医院和个人用器械(General Hospital and Personal Use Devices)专家组将在3月5日于马里兰州盖瑟斯堡举行的会议上讨论此问题。 FDA在一封致该小组的介绍信中说道:...
-
FDA警告托吡酯增加出生缺陷风险
环球医学资讯

 1小时0条评论
1小时0条评论3月7日消息 - 前沿医学资讯网据悉,美国食品和药物管理局(FDA)警告,育龄期妇女服用抗癫痫药物托吡酯可增加其婴儿罹患口腔出生缺陷风险。 监管机构近日表示,从收集的孕妇登记数据显示,在孕期前3个月服用抗癫痫药物托吡酯的母亲所生婴儿罹患唇裂和颚裂的...
-
FDA专家小组反对批准用于治疗潮热的2种非激素类药物
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论美国食品和药物管理局(FDA)生殖健康药物专家小组投票反对批准2种用于治疗中度至重度绝经期产生的血管舒缩症状的非激素类药物。 尽管所有的生殖健康药物专家小组成员一致认为,确实需要非激素类的药物来减轻给许多绝经后妇女的生活带来困扰的潮热症状,他们还是决定...
-
FDA拒绝遗传性血管性水肿治疗药物Rhucin的上市申请
环球医学资讯

 1小时0条评论
1小时0条评论3月3日消息 - 前沿医学资讯网据悉,Santarus公司宣布,美国食品和药物管理局(FDA)未接受其药物Rhucin的上市申请。该药用于治疗一种遗传性疾病——遗传性血管性水肿(HAE),该病可导致危险的咽喉和四肢肿胀。 FDA的决定可能导致Rhucin的获批延迟一年余。据...
-
FDA拒绝遗传性血管性水肿治疗药物Rhucin的上市申请
环球医学资讯

 1小时0条评论
1小时0条评论3月3日消息 - 前沿医学资讯网据悉,Santarus公司宣布,美国食品和药物管理局(FDA)未接受其药物Rhucin的上市申请。该药用于治疗一种遗传性疾病——遗传性血管性水肿(HAE),该病可导致危险的咽喉和四肢肿胀。 FDA的决定可能导致Rhucin的获批延迟一年余。据...
-
FDA警告西格列汀可引起急性胰腺炎
环球医学资讯

 1小时0条评论
1小时0条评论3月3日消息 - 美国食品药品管理局(FDA)近日宣布对西格列汀(sitagliptin,商品名:Januvia)和西格列汀与二甲双胍的复方制剂 Janumet的说明书进行修订,增加关于患者使用这些药品发生急性胰腺炎的病例报告。 西格列汀是一种新型糖尿病治疗药,经批准作为饮...
-
FDA批准通过百时美施贵宝防肾移植排异反应药Belatac…
环球医学资讯

 1小时0条评论
1小时0条评论3月3日消息 - 近日,FDA心血管及肾脏疾病治疗药顾问委员会就是否批准百时美-施贵宝Belatacept进行了投票,结果为13票赞成,5票反对。Belatacept属选择性共激活阻断药,用于新接受肾移植手术的患者,以防止急性排异反应。 在Belatacept的生物制剂许可申请中,...
-
美国FDA批准罗氟司特用于治疗慢性阻塞性肺疾病
环球医学资讯

 1小时0条评论
1小时0条评论3月1日消息 - 前沿医学资讯网据悉,美国食品和药物管理局批准罗氟司特(每日1粒)用于减少严重慢性阻塞性肺疾病(COPD)病情加重或症状恶化的频率。 慢性阻塞性肺病是一种导致呼吸困难的严重肺部疾病,其症状包括呼吸困难、慢性咳嗽、多痰。病情恶化可持续数...
-
Telatinib联合化疗治疗胃癌的SPA已提交于FDA
环球医学资讯

 1小时0条评论
1小时0条评论3月2日消息 - 前沿医学资讯网据THE MEDICAL NEWS网站报道,致力于开发针对性极强的口服癌症疗法的ACT生物技术公司近日宣布,它已经向美国食品和药物管理局(FDA)提交了一份特殊试验方案评价(SPA)申请,其是关于telatinib联合化疗用于晚期胃癌患者一线治疗的3...
-
FDA计划制定药品与诊断用品共同发展指南
环球医学资讯

 1小时0条评论
1小时0条评论3月2日消息 - FDA预计将于今年年末完成对药品与诊断用品共同发展指南文件的制定,该指南文件可用于指导个体化医疗,FDA专员Margaret Hamburg 于2月25日在华盛顿特区召开的一次会议上表示。 该指南将阐明FDA对如下问题的期望,即为证明某种诊断试验“结果准确...
-
FDA批准18F-氟化钠注射液NDA
环球医学资讯

 1小时0条评论
1小时0条评论2月11日消息 - 前沿医学资讯网据悉,美国国家癌症研究所(NCI)和国立卫生研究院(NIH)宣布,美国食品和药物管理局(FDA)已经批准了一个以前获批药物氟化钠F18(F18-氟化钠)注射液应用于骨扫描的新药申请(NDA)。PETNET Solutions公司是美国西门子医疗系统的...
-
美国FDA批准利拉鲁肽用于治疗2型糖尿病
环球医学资讯

 1小时0条评论
1小时0条评论2月11日消息 - 利拉鲁肽是第一个被批准用于治疗2型糖尿病的人胰高糖素样肽-1(GLP -1)类似物,每日给药1次。它适用于与饮食和运动进行联合治疗,以改善2型糖尿病成人患者的血糖控制情况。它可作为单药治疗,也可与常用口服降糖药联合使用。 研究人员称:“...
-
FDA批准阿斯利康降醇药Crestor新适应症
环球医学资讯

 1小时0条评论
1小时0条评论2月11日消息 - 美国FDA已批准阿斯利康畅销降醇药Crestor的扩大适应症,即用于那些胆固醇水平正常或略高的人士,作为预防药物。 至此,Crestor可用于那些在临床上未发现冠心病迹象的人士,以减少中风、心肌梗塞和接受冠状动脉血管再造术的风险。但是某些适用...
-
FDA将13种药物添加到观察名单
环球医学资讯

 1小时0条评论
1小时0条评论2月9日消息 - 前沿医学资讯网据Medscape报道,基于不良事件报告系统(AERS)识别的潜在严重风险迹象或新的安全信息,美国食品和药物管理局(FDA)已经发布了最新的药品观察清单。该季度的观察名单包括治疗多种疾病的13种药物,例如咳嗽、心绞痛、糖尿病、癌症和...
-
FDA警告后,在痴呆症治疗中非典型抗精神病药物使用…
环球医学资讯

 1小时0条评论
1小时0条评论2月9日消息 - 前沿医学资讯网据悉,近日,据美国医学会期刊之一《Archives of General Psychiatry》2月刊中的一篇报告报道,美国食品和药物管理局(FDA)发布的关于非典型抗精神病药物用于老年痴呆症治疗的警告与这些药物在老年痴呆症患者治疗中的使用显著下降相...
-
雅培公司监测卵巢上皮癌复发和发展的HE4检测申请FDA…
环球医学资讯

 1小时0条评论
1小时0条评论2月9日消息 - 一种帮助医生监测卵巢癌患者病情的新型诊断工具ARCHITECT HE4可能不久将在美国上市。雅培公司的ARCHITECT HE4检测采用简单的血液测试,帮助医生监控卵巢上皮癌患者的复发和病情进展。这个重要的免疫测定将是在美国上市的第一个自动化HE4检测。\ ...
-
Dupuytren挛缩治疗药Xiaflex获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论2月8日消息 - Xiaflex(溶组织梭菌胶原酶)已被美国FDA批准作为首个腱膜挛缩症即Dupuytren挛缩或杜普伊特伦挛缩(一种手残疾)治疗药物。 该种影响手掌结缔组织的残疾会影响患者手指的伸直和使用。 该机构在一次新闻发布会上说,Dupuytren挛缩在白人和50...
-
FDA批准抗癌药物——盐酸多柔比星脂质体的仿制药
环球医学资讯
 环球医学编写
环球医学编写 1小时0条评论
1小时0条评论卫生监管部门已批准抗癌药物——盐酸多柔比星脂质体(Doxil)的仿制药,此举可能会缓解长达数月威胁到成千上万名患者生命的不足之处。 美国食品和药物管理局(FDA)周一表示,已批准的Doxil的仿制药称为多柔比星的HCI脂质体注射液,是由印度太阳制药工业有...
-
FDA发布警告称HIV治疗药物Videx可导致非肝硬化性门…
环球医学资讯

 1小时0条评论
1小时0条评论2月2日消息 - 美国食品药品管理局(FDA)于2010年1月29日新发布了有关人类免疫缺陷病毒(HIV)感染治疗药物Videx和Videx EC(去羟肌苷)的紧急安全警告。FDA收到有关接受去羟肌苷治疗的患者发生非肝硬化性门静脉高压症的报告,并已对其药物说明作了相应修改。 去羟...
-
LibiGel或将成为首个FDA批准治疗绝经妇女HSDD药物
环球医学资讯

 1小时0条评论
1小时0条评论1月12日消息 - 前沿医学资讯网据THE MEDICAL NEWS网站报道,从事女性性健康治疗产品研发的BioSante制药公司(NASDAQ:BPAX)近日公布了一项100余名产科/妇科医师和初级保健医师参与的关于需要一个经FDA批准的药物来治疗女性性功能障碍(FSD)即性欲减退功能障碍...
-
新型OTC创口处理凝胶Prontosan通过FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论1月12日消息 - B.Braun制药公司推出一种新型非处方创口处理凝胶——Prontosan创口胶。2010年11月份,这种产品就已经获得了FDA的批准。 Prontosan创口胶含有聚己缩胍(PHMB)和甜菜碱(Betaine)两种成分,可用于急性和慢性创口的清洁、保湿和消毒,可以提高...
-
SFDA:“验胎灵”请勿购买
环球医学资讯

 1小时0条评论
1小时0条评论1月12日消息 - 国家食品药品监督管理局(SFDA)1月5日发布消费警示,为保障孕妇的身体健康,请广大消费者提高警惕,不要购买“验胎灵”及相类似的产品。 国家食品药品监督管理局指出,近日有部分媒体报道某些互联网网站在销售一种名为“验胎灵”的产品。销售...
-
FDA警告:早孕反应药Nzu中发现大量的铅和砷
环球医学资讯

 1小时0条评论
1小时0条评论1月12日消息 - FDA与德克萨斯州健康服务部于2009年12月31日联合公布了一项通知,警告消费者勿服药品Nzu。 德克萨斯州健康服务部实验室分析发现,治疗早孕反应的传统药物Nzu中含大量铅和砷。铅接触可致许多不良反应,且易对尚在发育阶段儿童的大脑和神经系统...
-
FDA批准Actemra治疗中-重度风湿性关节炎
环球医学资讯

 1小时0条评论
1小时0条评论1月12日消息 - 罗氏旗下的基因泰克事业部近日表示,FDA已批准Actemra(tocilizumab)用于治疗那些已对一种或多种肿瘤坏死因子拮抗剂应答不充分的成人中-重度风湿性关节炎(RA)患者。它是首个获准治疗该病的白介素6受体抑制类单克隆抗体药物,可单独使用,也可以...
-
FDA警告治疗失眠的药物应该使用低剂量
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论美国医疗监管机构警告说,晚上服用治疗失眠的处方药可能损害第二天的驾驶能力和警觉性,因此建议睡前低剂量服用该药。 上周四,美国食品和药物管理局在其网站上称,新数据显示,早上服用唑吡坦后,其药物浓度可能高到足以影响患者的警觉性。监管人员补充道,因为女性...
-
FDA和EMA均同意快速审查boceprevir
环球医学资讯

 1小时0条评论
1小时0条评论1月11日消息 - 前沿医学资讯网据THE MEDICAL NEWS网站报道,默克公司(在美国和加拿大之外称之为默沙东)近日宣布,该公司于2010年提交的口服丙型肝炎病毒(HCV)蛋白酶抑制剂boceprevir的监管申请已获得美国和欧盟批准进行快速审查。 美国食品和药物管理局...
-
SFDA:警惕血液透析装置的使用风险
环球医学资讯

 1小时0条评论
1小时0条评论1月11日消息- 国家食品药品监督管理局(SFDA)1月4日发布2011年第1期医疗器械不良事件信息通报,提醒专业医护人员及使用者警惕血液透析装置的使用风险。 SFDA介绍,血液透析装置是利用半透膜原理,通过弥散、对流和过滤等作用,将患者血液中的各种有害及...
-
FDA着手解决关于儿童麻醉风险的长期争论
环球医学资讯

 1小时0条评论
1小时0条评论1月11日消息 - 目前,FDA准备着手解决关于儿童麻醉潜在风险的长期争论,将于3月10日召开麻醉与生命支持药品顾问委员会会议对此进行讨论。 FDA要求专家小组讨论有关儿童使用麻醉剂的人类流行病学研究的新发现以及有关动物幼仔暴露于麻醉剂后出现神经退化效应...
-
FDA称强生治疗糖尿病新药可能导致心脏病风险
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论美国药物评论在周二公布的文件上称,由强生(Johnson&Johnson,J&J)公司研发的一种治疗糖尿病的新药,在临床试验中升高了不良胆固醇的水平,可能会造成心脏病的风险。 J&J正在检测治疗2型糖尿病的药物Canagliflozin,这是一种与肥胖和缺乏锻炼相关的疾病。糖尿病...
-
Lysteda的仿制药获得FDA审批
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论Watson制药公司称,其子公司已经获得监管部门对仿制药的审批,该药用于治疗经血过多。该公司表示将立即运送该产品。 Watson公司称,氨甲环酸片是Ferring制药公司的药物Lysteda的等价仿制药。Ferring公司已经对Watson公司提出了专利侵权诉讼,但是诉讼仍悬而未决。 Wa...
-
SFDA发布医用透明质酸钠产品管理类别公告
环球医学资讯

 1小时0条评论
1小时0条评论1月8日消息 - 为加强医用透明质酸钠(玻璃酸钠)产品的监督管理,进一步规范申报和审批程序,保证公众用药用械安全有效,根据《药品管理法》和《医疗器械监督管理条例》相关规定,日前,国家食品药品监督管理局(SFDA)对该类产品监督管理有关事宜发布公告。 ...
-
FDA开始审批重新提交的NDA依泽替米贝和阿托伐他汀
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论美国FDA已经开始审批重新提交的新药申请(NDA)依泽替米贝和阿托伐他汀片,这是一种由默克公司研发的联合制剂。 默克公司期待FDA于2013年上半年完成审查。该公司正持续推进依泽替米贝和阿托伐他汀联合制剂在其他国家应用的申请计划。
-
治疗肺结核新药获FDA审批
环球医学资讯
 环球医学编译
环球医学编译 1小时0条评论
1小时0条评论美国卫生监管部门已经批准了治疗多种耐药结核的新疗法,这是40年来席卷世界的致命性疾病首次获得联邦政府的批准。 美国食品和药物管理局(FDA)称获批的药物名称为Sirturo,这是治疗成人TB的两种更强药效的药物——异烟肼和利福平无效时使用的一种替代疗法...
-
FDA批准启动VX15/2503治疗晚期实体瘤的1期试验
环球医学资讯

 1小时0条评论
1小时0条评论1月6日消息 - 前沿医学资讯网据THE MEDICAL NEWS网站报道,Vaccinex公司近日宣布,该公司已获得FDA的批准,将启动1期临床试验以评估候选治疗性抗体VX15/2503对晚期实体肿瘤患者的安全性、耐受性、药代动力学及药效学。 VX15/2503是一种拮抗导向蛋白4D(SEMA4...
-
SFDA对部分含特殊药品复方制剂实施电子监管
环球医学资讯

 1小时0条评论
1小时0条评论1月6日消息 - 从国家食品药品监督管理局(SFDA)网站获悉,SFDA决定对含麻黄碱类复方制剂(不包括含麻黄的中成药)、含可待因复方口服溶液、含地芬诺酯复方制剂实施电子监管。 据了解,SFDA对部分含特殊药品复方制剂实施电子监管,旨在进一步加强药品管理,...
-
FDA批准依曲韦林片新规格200mg
环球医学资讯

 1小时0条评论
1小时0条评论1月6日消息 - 前沿医学资讯网据悉,近日,美国食品和药物管理局(FDA)批准了INTELENCE®(英特莱®,Etravirine,依曲韦林)的标签更新,准许新增200mg规格。该药属于非核苷逆转录酶抑制剂(NNRTI),用于对NNRTI和其他抗逆转录病毒(ARV)药物治疗发生抵...
-
FDA对心血管器械上市审批缺乏有力证据支持
环球医学资讯

 1小时0条评论
1小时0条评论1月6日消息 - 医疗器械在临床中被广泛使用,并且对患者的并发症发生率和死亡率具有重要影响。然而,目前美国食品和药品管理局(FDA)对医疗器械批准证据尚未经过系统化评价。 为此,美国加州大学旧金山分校的Sanket S Dhruva等人进行了一项相关研究,目的在...
-
美国FDA公布扎那米韦安全性信息
环球医学资讯

 1小时0条评论
1小时0条评论1月6日消息 - 扎那米韦在美国用于治疗成年人和7岁以上儿童中由甲型和乙型流感病毒所致的单纯性急性疾病,在出现症状的2天内用药。扎那米韦用于预防流感适用于成年人和5岁以上儿童。 使用扎那米韦的局限性: 尚未证明扎那米韦对有气道基础疾病的患者有效...
-
胚胎干细胞治疗老年黄斑变性试验获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论1月5日消息 - 前沿医学资讯网据medscape报道,美国Advanced Cell Technology(先进细胞技术公司,ACT)1月3日表示,美国食品和药物管理局(FDA)已经批准其开展利用人类胚胎干细胞治疗老年黄斑变性(AMD,年龄相关性黄斑变性)的临床试验。 这是ACT第二个获...
-
Impax通用名多西环素片最终通过FDA销售批准
环球医学资讯

 1小时0条评论
1小时0条评论1月5日消息 - Impax制药公司通用名多西环素片简化新药申请已获得FDA的批准,该药属盐酸强力霉素缓释制剂,剂量包括75毫克和100毫克两种。 多西环素是一种四环素类抗菌药,可用于治疗立克次氏体感染、性接触感染、呼吸道感染、特种细菌感染、眼部感染、炭疽...
-
JVS-100治疗严重肢体缺血的II期试验获FDA批准
环球医学资讯

 1小时0条评论
1小时0条评论1月4日消息 - 前沿医学资讯网据THE MEDICAL NEWS报道,从事研发心血管疾病治疗新药的临床研究再生医学公司Juventas医疗宣布,美国FDA批准了评估其主导产品JVS- 100治疗严重下肢缺血(CLI)疗效及安全性的II期临床试验。JVS-100编码基质细胞衍生因子1(SDF - 1)...
-
FDA警告称“纯天然”减肥补充剂Fruta Planta含有危…
环球医学资讯

 1小时0条评论
1小时0条评论1月4日消息 - 2010年12月23日,美国食品药品管理局(FDA) 发布一则关于使用名为“Fruta Planta”的产品警告。FDA表示,一项实验室分析发现该产品含有受管制药品西布曲明,而西布曲明因为安全性原因于2010年10月从美国撤市。FDA已经收到多例与使用Fruta Planta有关...


































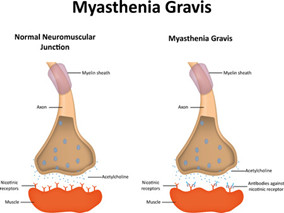







































































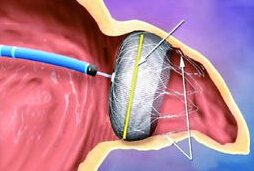


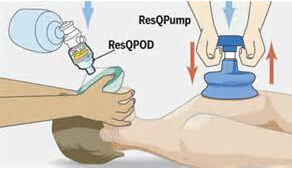




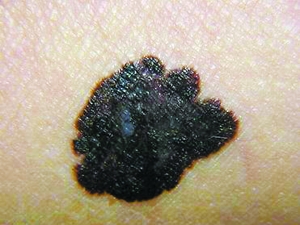

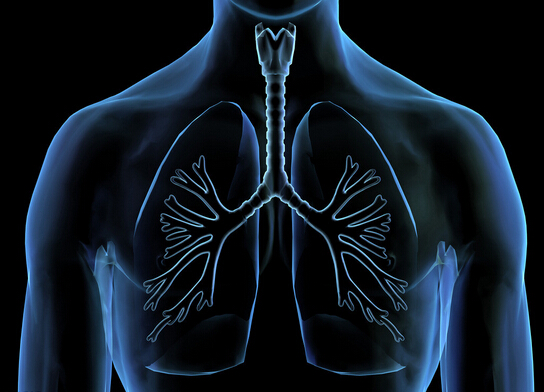



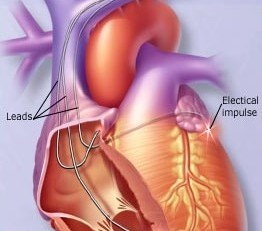
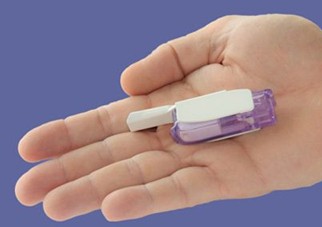



































































 会员登录
会员登录



网友评论
游客03-10
辅酶是否会增强LDH活性,长期看对患者是否不利?乳酸脱氢酶测定常用于诊断心肌梗死…
游客01-17
好文章
游客10-30
我今天看到你们这个消息给我增添了希望,在此表示感谢!【有研究结果表明,PCSK9单…